-
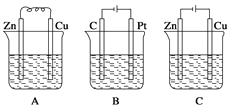
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为
A. a > b > c > d B. a > c > d > b C. c > a > b .> d D. b > d > c > a
难度: 中等查看答案及解析
-
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A. 过滤后的溶液中一定没有S2-
B. MnS难溶于水,可溶于MnCl2溶液中
C. 常温时,CuS、PbS、CdS比MnS更难溶
D. 加入MnS后生成CuS的离子方程式是Cu2+ + S2-= CuS↓
难度: 中等查看答案及解析
-
下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A. CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B. C(s) +1/2O2(g) ==CO(g); △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D. 2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
难度: 简单查看答案及解析
-
2014年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路—“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
难度: 简单查看答案及解析
-
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是

A. 该反应的热化学方程式为:N2+3H2
2NH3 △H=-92 kJ/mol
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热不改变
D. 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
难度: 中等查看答案及解析
-
下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2
N2O4(正反应为放热反应) B. C(s)+CO2
2CO(正反应为吸热反应)
C. N2+3H2
2NH3(正反应为放热反应) D. H2S
H2+S(s)(正反应为吸热反应)
难度: 简单查看答案及解析
-
反应A(g)+B(g)
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列说法可以证明反应N2(g)+3H2(g)
2NH3(g)已达到平衡状态的是
A. 1个N≡N键断裂的同时,有3个H—H键形成
B. 1个N≡N键断裂的同时,有3个H—H键断裂
C. N2、H2、NH3的分子数之比为1∶3∶2
D. 1个N≡N键断裂的同时,有6个H—N键形成
难度: 中等查看答案及解析
-
可逆反应mA(g)+nB(g)
pC(g)+qD(g),如右图所示是A的转化率同压强、温度的关系,分析图像结论正确是
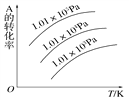
A. 正反应吸热,m+n>p+q B. 正反应吸热,m+n<p+q
C. 正反应放热,m+n > p+q D. 正反应放热,m+n < p+q
难度: 中等查看答案及解析
-
在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1,在一定条件下发生反应:A(g)+B(g)
2C(g),该温度下,此反应的平衡常数为4,则A的转化率为
A. 30% B. 40% C. 50% D. 60%
难度: 中等查看答案及解析
-
下列各反应中属于水解反应的是
A. HCO3-﹣+H2O
H3O++CO32- B. HCO3﹣-+H2O
H2CO3+OH-
C. HCO3-﹣+OH-﹣=H2O+CO32- D. HCO3-+H3O+=2H2O+CO2↑
难度: 中等查看答案及解析
-
已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
A. 对比等浓度的两种酸的pH
B. 对比等浓度的两种酸,与相同大小镁条反应的初始速率
C. 对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的总体积
D. 对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量
难度: 中等查看答案及解析
-
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. 0.1 mol/L的(NH4)2SO4溶液中:c(SO
)>c(NH
)>c(H+)>c(OH-)
B. 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO
)+c(H2CO3)+2c(CO
)
C. 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D. 在25℃0.1 mol/L的 NH4Cl溶液中:c(Cl-)=c(NH
)+c(NH3·H2O)
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、Al3+、Cl-、SO42-
B. 室温下,pH=1的盐酸中:Na+、Fe2+、NO3-、SO42-
C. 含有Ca2+的溶液中:Na+、K+、CO32-、Cl-
D. 水电离产生的c(H+)=1×10-13 mol/L的溶液中:Na+、K+、Cl-、SO42-
难度: 中等查看答案及解析
-
用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是
A. c(OH-)/ c(NH3·H2O) B. c(NH
)/ c(OH-)
C. c(NH3·H2O)/ c(NH
) D. c(OH-)
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C. N2(g)+3H2(g)
2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D. 水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应
难度: 简单查看答案及解析
-
下列叙述中错误的是
A. 电解池的阳极上发生氧化反应,阴极上发生还原反应
B. 原电池跟电解池连接后,电子从电池负极流向电解池阳极
C. 电镀时,电镀池里的阳极材料发生氧化反应
D. 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
难度: 中等查看答案及解析
-
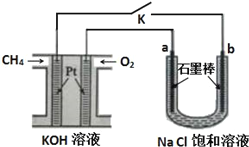
关于下列装置说法正确的是
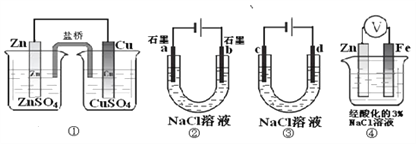
A. 装置①中,盐桥中的Cl-移向CuSO4溶液
B. 装置②工作一段时间后,a极表面生成了较多的O2
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,Zn极发生氧化反应
难度: 中等查看答案及解析