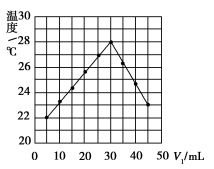
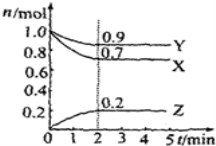
-
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol H2中的化学键消耗的能量为Q1 kJ,破坏1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学键释放的能量为Q3 kJ。下列关系中,正确的是
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2<Q3 D.Q1+Q2<2Q3
难度: 中等查看答案及解析
-
下列各组中属于同位素关系的是
A.
与
B.T2O与H2O C.
与
D.金刚石与石墨
难度: 简单查看答案及解析
-
在下列过程中,需要加快化学反应速率的是
A.钢铁腐蚀 B.食物腐烂 C.工业炼钢 D.塑料老化
难度: 中等查看答案及解析
-
下列性质可以证明某化合物内一定存在离子键的是
A.可溶于水 B.熔融状态能导电
C.水溶液能导电 D.具有较高熔点
难度: 中等查看答案及解析
-
下列关于元素周期表的说法正确的是
A、元素周期表目前共有8个周期
B、元素周期表中共有十八个族,其中有主族、副族、0族和VIII族
C、元素周期表中第一、二、三周期为短周期
D、元素周期表中第IA族全部是金属元素
难度: 中等查看答案及解析
-
在容器中充入SO2和只由18O原子组成的氧气(18O2)。在一定条件下达到平衡时,18O存在于
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于SO2和SO3中
D.SO3、SO2和O2中都有可能存在
难度: 简单查看答案及解析
-
下列所有元素组合,既可以形成离子化合物,又可形成共价化合物的一组是
A.H、C、O、K B.H、N、O
C.H、O、S D.H、O、S、Na
难度: 中等查看答案及解析
-
对于
和
+ 两种粒子,下列叙述正确的是
A.质子数一定相同,质量数和中子数一定不同
B.化学性质几乎相同
C.一定都由质子、中子、电子构成
D.核电荷数、核外电子数一定相同
难度: 中等查看答案及解析
-
下列各组元素性质的递变情况错误的是
A.N、O、F原子半径依次减小
B.P、S、Cl元素最高正价依次升高
C.Li、Be、B原子最外层电子数依次增多
D.Na、K、Rb的电子层逐渐减少
难度: 中等查看答案及解析
-
XY2 是离子化合物,X和Y的离子的电子层结构与氖原子的相同,则X、Y为
A、Na和Cl B、K和S C、Ca和F D、Mg和F
难度: 中等查看答案及解析
-
某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键
A、一定是离子键 B、一定是共价键
C、可能是离子键也可能是共价键 D、以上说法都不正确
难度: 中等查看答案及解析
-
已知2H→H2并放出437.6kJ的热量,下列说法正确的是
A、氢气分子内每个氢原子都达到8电子稳定结构
B、氢气分子的能量比氢原子的能量低
C、1molH2离解成2molH 要放出437.6kJ 热量
D、氢原子的还原性比氢分子的还原性弱
难度: 中等查看答案及解析
-
在共价化合物中,成键原子通过共用电子对形成共价键,共用电子对由双方共同提供并且共同分享,那么,在共价化合物中元素化合价有正负之分的主要原因是
A、电子有得失 B、共用电子对有偏移
C、电子既有得失又有偏移 D、金属元素的存在
难度: 中等查看答案及解析
-
已知:①能量越低的物质就越稳定;②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相同
D.红磷容易发生自燃而白磷则不会自燃
难度: 中等查看答案及解析
-
已知化学反应2C(s)+O2(g)=2CO(g)和2CO(g)+O2(g)=2CO2(g)都是放热反应。据此判断,下列说法中不正确的是(其他条件均相同)
A.12 g C所具有的能量一定高于28 g CO所具有的能量
B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
难度: 中等查看答案及解析
-
下列叙述中可以说明反应2HI(g)
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分组成HI%=I2%
④反应速率v(H2)=v(I2)=1/2v(HI)
⑤[HI]∶[H2]∶[I2]=2∶1∶1
⑥v(HI)分解=v(HI)生成
⑦压强不变
A.①③⑤ B.②⑥ C.④⑤ D.④⑥⑦
难度: 中等查看答案及解析