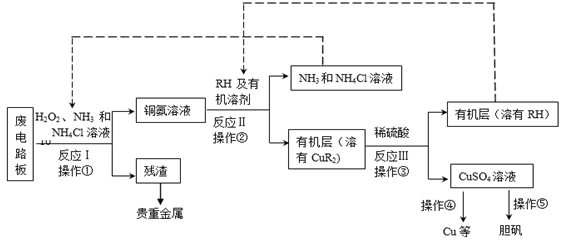
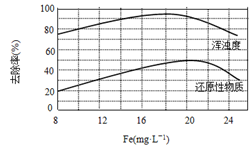
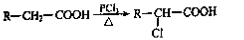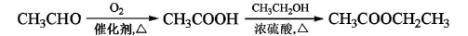-
下列有关“化学与生活”的叙述不正确的是
A.点燃爆竹后,硫燃烧生成SO3
B.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C.服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒
D.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
难度: 中等查看答案及解析
-
下列关于物质或离子检验的叙述正确的是
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
难度: 中等查看答案及解析
-
下列说法不正确的是
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
难度: 中等查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
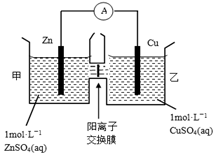
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 困难查看答案及解析
-
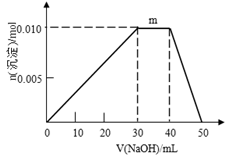
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质
结论
A
50mL 1 mol·L-1H2SO4
反应结束后,c(Na+)=c(SO42-)
B
0.05molCaO
溶液中
增大
C
50mL H2O
由水电离出的c(H+)·c(OH—)不变
D
0.1molNaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
难度: 困难查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
难度: 困难查看答案及解析

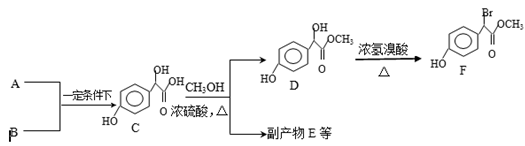
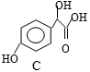 中①、②、③3个—OH的酸性有强到弱的顺序是:_____________。
中①、②、③3个—OH的酸性有强到弱的顺序是:_____________。