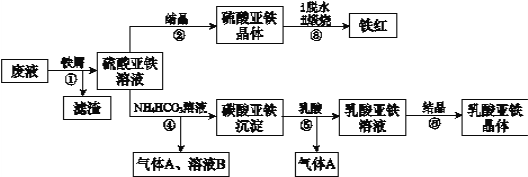
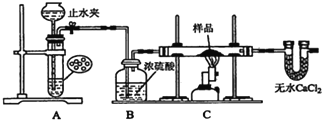
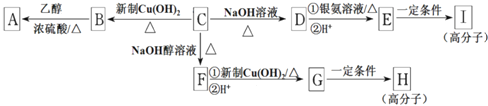
-
下列实验的现象所得到的结论正确的是
选项
实验操作
现象
结论
A
向溶有SO2的BaCl2溶液中通入气体X
产生白色沉淀
X一定是Cl2
B
向NaClO和NaOH的混合溶液中加入H2O2浓溶液
产生大量气泡
碱性条件下,H2O2被ClO-氧化成O2
C
等体积pH=3的HA和HB两种酸溶液分别于足量的锌反应
HA放出的H2多
酸性:HA﹥HB
D
将铜片和铁片用导线连接插入浓硝酸中
铁片表面有气泡产生
金属活动性:Cu﹥Fe
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述中正确的是
A. 向0.1mol/LFeCl2溶液中通入足量Cl2,所得Fe3+数目小于0.1NA
B. 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电于数为0.2NA
C. 标准状况下,将3.36LCl2通入1L0.2mol/LFeBr2溶液中被氧化的Br-数目为0.1NA
D. 标准状况下,11g由3H和16O组成的超重水中,中子数和电子数之和为10NA
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化物,q是W的单质。下列说法不正确的是
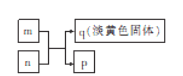
A. 原子半径:Z>W>Y>X
B. 简单氢化物的稳定性:Y>W
C. m、n、p均为只含极性键的共价化合物
D. Z、W形成的化合物可由两种盐溶液通过复分解反应制得
难度: 中等查看答案及解析
-
下列关于有机化合物的结构,性质的叙述正确的是
A. 糖类、油脂、蛋白质的水解产物都是非电解质
B. 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别
C. 分子式为C4H8O的三元环同分异构体共有(不考虑立体异构)6种
D. 分子中含有一个或多个苯环的一类化合物,属于芳香烃
难度: 中等查看答案及解析
-
LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是
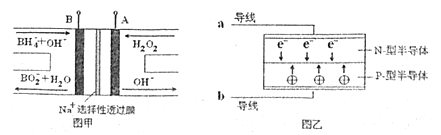
A.电池A极区的电极反应式为:H2O2+2e-=2OH-
B.电池放电过程中,Na+从负极区向正极区移动
C.每有1mol NaBH4参加反应转移电子数为4NA
D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
难度: 困难查看答案及解析
-
已知: 常温下,(1) Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是
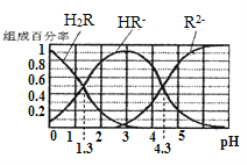
A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B. 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
C. 在pH=3的溶液中存在c(R2−)×c(H2R)/c2(HR−)=10-3
D. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-
难度: 困难查看答案及解析