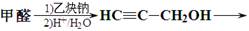-
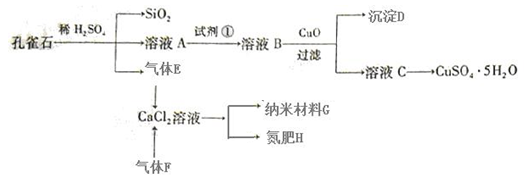
(14 分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入▲ (填化学式)。写出该反应的化学方程式▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是▲ (填名称);滴定达到终点的现象为▲ 。
-
(10分)钨是高熔点金属,工业上用黑钨铁矿[(Fe,Mn)WO4]冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下:
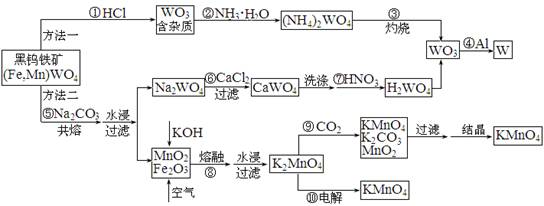
请根据图示及所学知识回答下列问题:
(1)写出反应④的化学方程式:▲ 。
(2)写出反应⑨的离子方程式:▲ 。
(3)方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净:▲ 。
(4)整个工艺流程所涉及的物质中,属于酸性氧化物的有▲ 。
(5)写出反应⑩中阳极反应的电极反应式:▲ 。
-
(10分)工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:
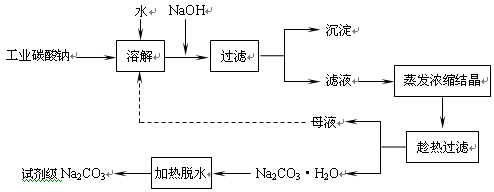
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

(1)加入NaOH溶液时发生的离子反应方程式为▲ 、▲ 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)▲ 。
(3)“趁热过滤”时的温度应控制在▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式▲ 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行▲ ,其理由是▲ 。
-
(10 分)SO2和NOx的排放是造成酸雨的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
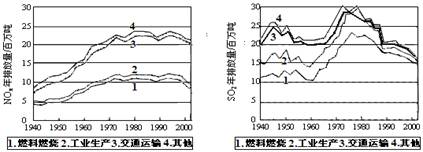
(1)结合上图数据,判断下列说法正确的是▲ 。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
▲ 。
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO  N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |

 在上述条件下反应能够自发进行,则反应的
在上述条件下反应能够自发进行,则反应的 ▲ 0(“>”、“<”、“=”)。
▲ 0(“>”、“<”、“=”)。 在该温度下,反应的平衡常数K=▲ 。
在该温度下,反应的平衡常数K=▲ 。
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62 [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请计算排放在空气中的NOx和SO2的物质的量之比接近于▲ 。
-
(12 分)某芳香烃的分子式为C12H14,其苯环上的一氯代物只有一种,A能发生如下图所示的转化,并最终制得合成纤维J和合成橡胶K。(某些反应条件已略去)

已知:

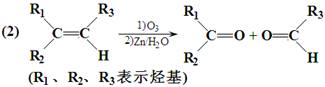

Ⅰ.请回答下列问题:
(1)A的结构简式▲ 。
(2)上述转化发生的反应中,属于消去反应的是▲ 。
(3)反应⑨的化学方程式是▲ 。
(4)请写出两种符合下列条件的B的同分异构体的结构简式:
①能与FeCl3溶液反应显色;②能与溴的CCl4溶液发生加成反应;③苯环上有三个取代基。
▲ 、▲ 。
Ⅱ.3-戊醇可作香料。以甲醛和乙炔钠为原料,其他试剂自选,完成其合成路线。
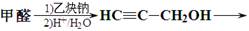 ▲ 。
▲ 。
-
(10分)合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:

其中反应②为:4NO+3O2+2H2O 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为▲ 。
-
(12 分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为▲ 。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为▲ 。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为▲ 。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为▲ 。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于▲ 。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为▲ (填序号)。
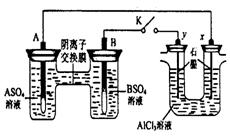
CaCO3↓+H2O
Cu2++SO2↑+2H2O
NH3·H2O+(5-a)Al(OH)3↓+(a-4)AlO2-
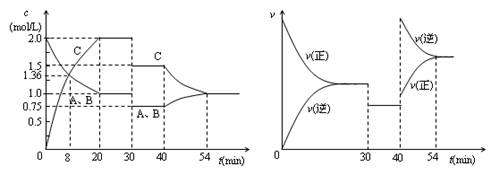
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是