-
下列实验操作、实验现象和实验结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
向待测溶液中先滴加几滴氯水,然后滴加KSCN 溶液
溶液变红
待测溶液中含有Fe2+
B
向KMnO4酸性溶液中滴加乙二酸
溶液褪色
乙二酸具有还原性
C
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O 能大
量共存
D
向10mL0.1mol· L-1Na2S溶液中滴入2mL0.1 mol· L-1 ZnSO4溶液,再加入0.1 mol· L-1CuSO4溶液
开始有白色沉淀生成;后有黑色沉淀生成
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
A、B、C、D为短周期原子序数依次增大的主族元素。其中:只有D为金属元素;A的某种同素异形体是自然界最硬的物质。下列说法一定正确的是
A. A、B、C三种元素最高价氧化物的水化物的酸性依次增强
B. 简单离子的半径大小顺序为:B>C>D
C. B、C分别与D形成的可溶于水的化合物的水溶液可以呈酸性、中性或碱性
D. 若B、C能形成化合物BC3,则该化合物中B的化合价为-3
难度: 中等查看答案及解析
-
明代名臣于谦作诗“凿开混沌得乌金,藏蓄阳和意最深。爝火燃回春浩浩,洪炉照破夜沉沉……”,诗中所写“乌金”是( )
A. 焦炭 B. 煤炭 C. 磁铁矿 D. 软锰矿
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中
的数目为0.2NA
难度: 简单查看答案及解析
-
某锂离子电池工作原理如下图所示,电池反应为:Li1-xCoO2+LixC
LiCoO2+C。下列说法不正确的是
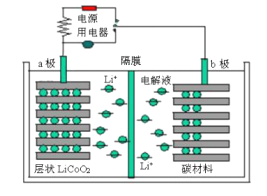
A. 放电时,电子从b极经用电器流向a极
B. 放电时,若转移1mol e-,碳材料将增重7 g
C. 充电时,锂离子通过隔膜进入右室
D. 充电时,a极反应:LiCoO2-xe-= Li1-xCoO2+xLi+
难度: 中等查看答案及解析
-
某温度下,已知醋酸的电离常数Ka= 1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)= 3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c( H+)>c(OH-)
B. 将相同浓度的CH3COOH 溶液与CH3COO Na 溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg 沉淀生成
难度: 困难查看答案及解析
-
对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
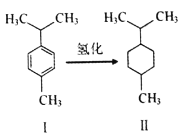
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
难度: 中等查看答案及解析
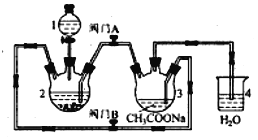
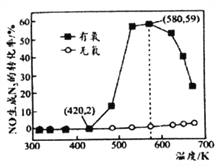
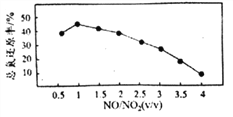
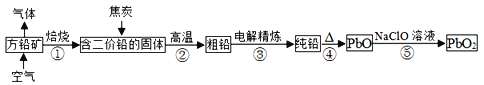
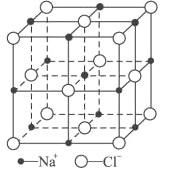 。
。