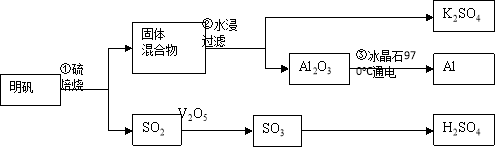
-
化学与生产、生活、社会密切相关。下列说法中不正确的是:
A.雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致
B.钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.绿色化学的核心是从源头上消除工业生产对环境的污染
D.硅胶可用作食品干燥剂和催化剂载体
难度: 简单查看答案及解析
-
下列关于NA的说法正确的是:
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.1 mol Cl2与足量的铁反应,转移的电子数为3NA
C.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA
D.1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1 NA个HCO3-
难度: 中等查看答案及解析
-
下列各环境中的离子组合能够大量共存的是:
A.pH=0的溶液:Al3+、NH4+、Ca2+、SO42-
B.无色溶液:Mg2+、SO42-、Fe3+、Cl-
C.加水稀释后溶液中c(OH-)/c(H+)明显减小的溶液:Na+、AlO2-、S2-、SO32-
D.加入铝粉产生H2的溶液中,Fe2+、K+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是:
A.Fe2O3溶于氢碘酸溶液中:Fe2O3 + 6H+ =2Fe3+ + 3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2 + AlO2- + 2H2O=Al(OH)3↓+ CO32-
C.NH4HCO3溶于过量的浓KOH溶液:NH4+ + HCO3- + 2OH- =CO32- + NH3↑+ 2H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO4 2- 恰好完全沉淀:2Ba2+ + 3OH- + Al3+ + 2SO42- =2BaSO4↓ + Al(OH)3↓
难度: 困难查看答案及解析
-
不小心使皮肤粘上了高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)稀溶液洗涤,黑斑可迅速褪去,其离子方程式为:MnO4- + H2C2O4+ H+→ CO2 ↑ + Mn2+ + ,下列有关叙述正确的是:
A.发生还原反应的是:H2C2O4
B.该离子方程式右侧横线上的产物是OH-
C.10 mol二氧化碳生成时,电子转移5 mol
D.通常用H2SO4 溶液而不用盐酸酸化KMnO4 溶液
难度: 中等查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器
甲
乙
丙
容积
0.5 L
0.5 L
1.0 L
温度/℃
T1
T2
T2
反应物起始量
1.5 mol A
0.5 mol B
1.5 mol A
0.5 mol B
6.0 mol A
2.0 mol B

下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
难度: 困难查看答案及解析
-
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/(mol•L-1)
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是:
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
难度: 困难查看答案及解析