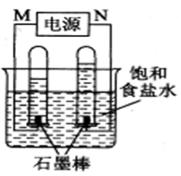
-
下列有关物质的性质与应用不相对应的是
A. 明矾能水解生成Al(OH)3 胶体,可用作净水剂
B. FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路
C. SO2 具有氧化性,可用于漂白纸浆
D. Zn 具有还原性和导电性,可用作锌锰干电池的负极材料
难度: 简单查看答案及解析
-
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A.HF、CH3CH2OH、KOH 都易溶于水,都是电解质
B.HClO、H2SO4(浓)、稀HNO3 均具有强
氧化性,都是氧化性酸
C.H2O、HCOOH
、Cu2(OH)2CO3 均含有氧元素,都是氧化物
D.HCOOH、H2CO3、H2S 分子中均含有两个氢原子,都是二元酸
难度: 简单查看答案及解析
-
某无色透明溶液中可能含有以下离子中的若干种K+
、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、CO32-、I-和Cl-,取该溶液进行如下实验:
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶
液,有白色沉淀生成,当NaOH过量时,又有部分白色
沉淀溶解。根据以上现象判断原溶
液中:
A.②中无色气体中有NO,可能含CO2
B.③中
沉淀有B
aSO4,可能含BaCO3
C.肯定存在的离子是Al3+、SO42-、 NO3-、Mg2+,肯定不存在的离子是Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+ 、 Cl-
D.②中红棕色气体通入水中发生反应的离子方程式为:3NO2 + H2O = H++ NO3- + 2NO
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.100 mL 2.0 mol·L-1 NH4Cl溶液中含有NH4+ 的数目为0.2NA
B.25℃时,pH=13的Ba(OH)2溶液中含有OH
-的数目为0.2NA
C.标准状况下,2.24L庚烷含有的分子数为0.1NA
D.常温常压下,NO2与足量H2O反应生成0.1molNO,则转移的电子数为0.2NA
难度: 困难查看答案及解析
-
下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶中的液体时,取下瓶塞倒放在
桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体
⑨稀释浓硫
酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩ B.①④⑤⑦⑩ C.①④⑤⑦⑧⑩ D.④⑤⑦⑩
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. Na2O2投入水中:2Na2O2+2H2O = 4Na++4OH−+ H2↑
B. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O = HClO+HSO3-
C. 钠投入CuSO4溶液中:2Na+Cu2++2H2O = 2Na++Cu(OH)2↓+H2↑
D. 铜和稀HNO3反应:3Cu+8H++2NO3- = 3Cu2++2NO2↑+4H2O
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2
则有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e—+OH-=NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH- 向正极移动
难度: 困难查看答案及解析