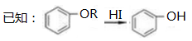-
下列关于化学键的说法,正确的是
A.化合物中一定没有非极性键
B.单质中不可能含有离子键
C.金属元素与非金属元素间形成的键均是离子键
D.CO2、CH4分子中每个原子最外层均形成了8电子结构
难度: 中等查看答案及解析
-
把等物质的量的Na2SO4、NaCl和AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是
A.H2 B.Ag C.Cl2 D.O2
难度: 中等查看答案及解析
-
水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
难度: 中等查看答案及解析
-
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是
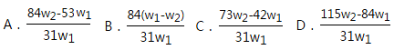
难度: 中等查看答案及解析
-
下列说法正确的是
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同;
B.同温同压下,反应H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同;
C.已知:①2H2(g)+O2(g) == 2H2O(g) ΔH=-a kJ/mol,
②2H2(g)+O2(g) == 2H2O(l) ΔH=-b kJ/mol,则a>b;
D.已知:①C(s,石墨)+O2(g) == CO2(g) ΔH=-393.5 kJ/mol,
②C(s,金刚石)+O2(g) == CO2(g) ΔH=-395.0 kJ/mol,则
C(s,石墨) == C(s,金刚石) ΔH=+1.5 kJ/mol;
难度: 中等查看答案及解析
-
在100 mL含等物质的量的HBr和H2SO3的溶液中通入0.025 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
A.0.16 mol·L-1 B.0.02 mol·L-1 C.0.20 mol·L-1 D.0.25 mol·L-1
难度: 困难查看答案及解析
-
下列说法正确的是
A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中反应生成NH3(g),反应达到平衡时放出的热量为7.72kJ,其热化学方程式为:
 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1C.对于可逆反应
 △H﹤0,升高温度,可使反应速率增大,反应逆向移动
△H﹤0,升高温度,可使反应速率增大,反应逆向移动D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系。
难度: 中等查看答案及解析
-
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
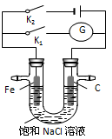
A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
难度: 中等查看答案及解析
-
用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
选项
操作及现象
溶液
A
通入CO2,溶液变浑浊
饱和Na2CO3溶液
B
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
Na2SiO3溶液
C
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
Ca(ClO)2溶液
D
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊
澄清石灰水
难度: 中等查看答案及解析
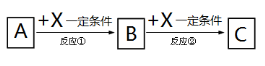
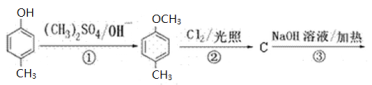
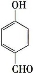 。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
。有人提出,以对甲基苯酚为原料合成PHBA的途径如下: