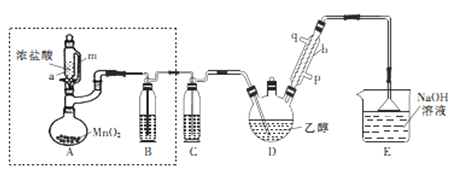
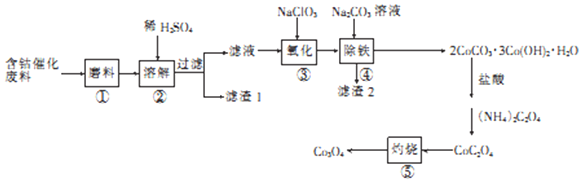
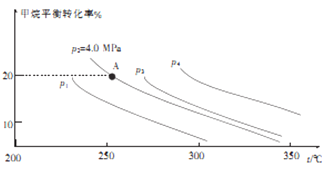
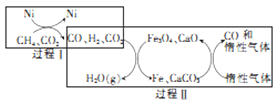
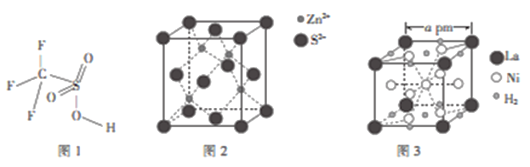
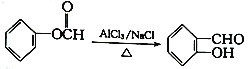-
下列根据实验现象得H 的实验结论正确的是
选项
实验操作
实验现象
实验结论
A
将Fe(N03)2样品溶于稀硫酸后,滴加KSCN溶液
溶液变成红色
Fe(NO3)2样品中一定含有Fe3+
B
向KI溶液中加入少量苯,然后加入FcCl3溶液
有机层呈橙红色
还原性 Fe3+>I-
C
向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液滴入少量AgNO3溶液
产生黑色沉淀(Ag2S)
Ksp(Ag2S)>Ksp(Ag2CO3)
D
向某溶液中加入KOH溶液并加热,管口放湿润的红色石蕊试纸
试纸变为蓝色
原溶液片含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生产、生舌密切相关,下列说法正确的是
A. 维生素D可促进人体对钙自吸收
B. 可以直接用淀粉溶液检验海水中是否含碘元素
C. 有机玻璃的主要成分是硅酸盐
D. 石油的分馏过程主要涉及化学变化
难度: 简单查看答案及解析
-
中华诗句华丽优美且富含哲理,古人常将化学知识融入诗句中,以下诗句包含化学变化的是
A. 南朝四百八十寺,多少楼台烟雨中
B. 女娲炼石补天处,石破天惊逗秋雨
C. 千淘万漉虽辛苦,吹尽狂沙始到金
D. 水声冰下咽,沙路雪中平
难度: 简单查看答案及解析
-
化合物
 (b)、
(b)、 (d)、CH≡C—CH=CH2(p)的分子式均为C4H4。下列说法正确的( )
(d)、CH≡C—CH=CH2(p)的分子式均为C4H4。下列说法正确的( )A. b的一氯代物只有两种 B. d的同分异构体只有b、p两种
C. b.d.p均可与溴水发生加成反应 D. p的所有原子不可能处于同一平面
难度: 简单查看答案及解析
-
用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。

下列说法正确的是
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43- 除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++02-4H++4P043-=4FePO4↓+2H2O
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。W原子的最外层电子数是次外层的3倍,X在周期表中位于IIIA族,Y与W位于同一主族。下列说法正确的是
A. 化合物Y2Z2中既含有离子键,又含有共价键
B. 最简单气态氢化物的热稳定性:W>Y>Z
C. 简单离子的半径:X<W<Y
D. 工业上:常用电解熔融的XZ3制备Z单质
难度: 中等查看答案及解析
-
20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确确是
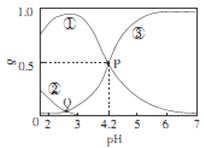
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol/L的NaHC204 溶液中:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
难度: 困难查看答案及解析