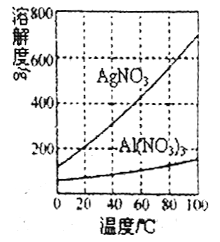
-
化学与生产、生活、.科技、环境等密切相关。下列说法正确的是
A. 地沟油禁止用于食品用油,但可以用于制肥皂
B. 碳纤维是一种新型的高强度的有机髙分子材料
C. 光化学烟雾、硝酸型酸雨的形成都与煤的大量燃烧有关
D. 用漂粉精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更佳
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 乙醛分子的比例模型:
 B. 碳基硫的电子式:
B. 碳基硫的电子式:C.
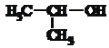 的名称:2-甲基乙醇 D. 氢化钠与重水反应的化学方程式:NaN+D2O=NaOH + D2↑
的名称:2-甲基乙醇 D. 氢化钠与重水反应的化学方程式:NaN+D2O=NaOH + D2↑难度: 中等查看答案及解析
-
下列物质的性质与用途具有对应关系的是
A. 明矾易溶于水,可用作净水剂
B. 二氧化硅熔点高,可用作光导纤维
C. 二氧化硫有氧化性,可用于漂白纸张
D. 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂
难度: 中等查看答案及解析
-
实验室拟制备纯净的氯气并回收剩余药品,下列图示装置和原理能达到实验目的的是
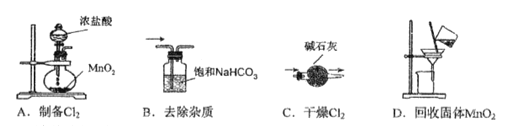
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
X、Y、Z、W、R是原了序数依次递增的短周期元素。X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,Z为短周期中金属性最强的元素,W是地売中含量最高的金属元素。下列叙述正确的是
A. Y、Z、W原子半径依次增大
B. 元素W、R的简单离子具有相同的电子层结构
C. X的最高价氧化物对应水化物的酸性比R的强
D. X、R分别与Y形成的常见化合物中化学键类型相同
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 向碳酸钠溶液中加入过量醋酸:CO32-+2H+=H2O+CO2↑
B. 向偏铝酸钠溶掖中通入过量二氧化碳;CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
C. 向莫尔盐(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氧化钠溶液:NH4++Fe2++3OH-=NH3·H2O+Fe(OH)2↓
D. 向双氧水中加入酸性高锰酸钾溶液:5H2O2+2MnO4-=2Mn2++5O2↑+6OH-+2H2O
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①FeS2
SO2
H2SO4 ②SiO2
SiCl4
Si
③饱和NaCl
NaHCO3
Na2CO3
④Al
NaAlO2
AlCl3(aq)
AlCl3(s)
⑤CuSO4(aq)
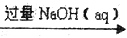 Cu(OH)2
Cu(OH)2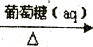 Cu2O
Cu2OA. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 困难查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= +49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ·mol-1
下列说法正确的是
A. CH3OH的燃烧热为192.9 kJ·mol-1
B. 反应①中的能量变化如图所示
C. CO2和H2转变成CH3OH的过程不一定要吸收能量
D. 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H<-192.9kJ·mol-1
难度: 困难查看答案及解析
-
在探究Ba2ClO(OH)3·H2O性质的实验中,取该物质溶解后,分别和下列溶液充分混合搅拌,反应后溶液中主要存在的一组离子正确的是
A. 加入过量浓盐酸:H+、Ba2+、Cl-、ClO-
B. 加入过量NaHCO3稀溶液:Na+、HCO3-、CO32-、ClO-
C. 加入过量Fe(NO3)2溶液:Ba2+、NO3-、Fe2+、ClO-
D. 加入过量Na2SO4溶液:Ba2+、ClO-、Na+、SO42-
难度: 中等查看答案及解析
-
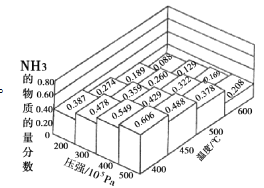
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
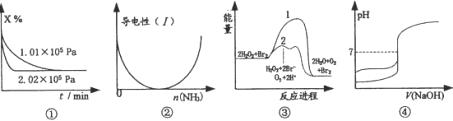
A. 图①表示不同压强对反应体系3X(g)
2Y(g)+Z(s)中X体积分数的影响
B. 图②表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图③中的线条2表示放热反应2H2O2=2H2O+O2加入催化剂Br2的反应进程
D. 图④表示用0.1000mol·L-lNaOH溶液分别滴定同浓度同体积盐酸和醋酸的曲线
难度: 中等查看答案及解析
-
4-AFMF是一种探测物质的荧光素,其结构简式如图所示。下列有关物质的说法不正确的是

A. 分子中三个苯环处于同一平面
B. 1mol 4-AFMF最多可与 2molNaOH反应
C. 在酸性条件下水解,水解产物只有1种
D. 能与溴水、FeCl3溶液及稀硫酸发生反应
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度
B. 增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积K w减小
C. pH=3的盐酸与pH=11的某碱溶液等体积混合溶液呈碱性,说明该碱为强碱
D. TATP(C 8H18O6 )受撞击分解爆炸且无明显热效应,说明该分解反应熵显著增加
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
2 min后,试管里出现凝胶
非金属性:Cl>Si
B
向滴有甲基橙的AgNO3溶液中滴加KC1溶液
溶液由红色变为黄色
KC1溶液具有碱性
C
在CuSO4溶液中加入KI溶液,再加入苯,振荡
有白色沉淀生成,苯层呈紫红色
白色沉淀可能为 CuI
D
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
常温下,下列有关叙述正确的是
A. 0.1 mol /L氨水中 c(H+)/c(OH -)=l×10-8,则 c(H+)=l×10-11 mol·L -1
B. pH=7 的 NH4Cl和NH3 ·H2O的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C. 在0.1 mol·L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
D. 浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
在体积为1L的恒温密闭容器中,充入1 mol CO2和3 mol H2,—定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是

A. 该化学反应在3 min时达到平衡状态
B. 保持其他条件不变,降低温度平衡时c(CH3OH) =0.85mol·L-1,则该反应的△H<0
C. 相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 molH2,平衡时CO2的转化率小于75%
D. 12 min时,向上述容器中再充入0.25 mol CO2、0. 25 mol H2O(g),此时反应将向逆反应方向进行
难度: 困难查看答案及解析