-
下列叙述中,正确的是
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
D.如果某一基态3p能级上仅有2个电子,它们自旋方向必然相反
难度: 中等查看答案及解析
-
下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
难度: 中等查看答案及解析
-
在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
难度: 简单查看答案及解析
-
三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是
A.PCl3分子中三个共价键的键长,键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能,键角均相等
D.PCl3是非极性分子
难度: 中等查看答案及解析
-
第三周期元素的原子,其最外层p能级上仅有一个未成对电子,它最高价氧化物对应的水化物的酸根离子是
A.RO B.RO C.RO D.RO
难度: 中等查看答案及解析
-
下列物质中,同时存在极性键、非极性键和氢键的是
A.CO2 B.H2O C.H2O2 D.C2H2
难度: 中等查看答案及解析
-
用带静电的有机玻璃棒靠近下列液体的细流,细流发生偏转的是
A.苯 B.二硫化碳 C.氯水 D.四氯化碳
难度: 中等查看答案及解析
-
下列各元素,最易形成离子化合物的是
①第三周期第一电离能最小的元素 ②外围电子构型为2s22p6的原子
③2p亚层为半满的元素 ④电负性最大的元素
A.①② B.③④ C.②③ D.①④
难度: 中等查看答案及解析
-
下列分子中,中心原子是sp杂化的是
A.BeCl2 B.H2O C.CH4 D.BF3
难度: 中等查看答案及解析
-
下列物质中,难溶于CCl4的是
A.碘单质 B.水 C.苯 D.甲烷
难度: 中等查看答案及解析
-
下列不能形成配位键的组合是
A.Ag+、NH3 B.BF3、NH3 C.Co3+、CO D.Ag+、H+
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D.气态氢化物的稳定性:HmY小于HmX
难度: 中等查看答案及解析
-
基态碳原子的最外能层的各能级中,电子排布的方式正确的是
A B C D
难度: 中等查看答案及解析
-
有关核外电子运动规律的描述错误的是
A.核外电子质量很小,在原子核外作高速运动
B.核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释
C.在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动
D.在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多
难度: 中等查看答案及解析
-
下列能级中轨道数为3的是
A.S能级 B.P能级 C.d能级 D.f能级
难度: 中等查看答案及解析
-
范德华力为a KJ·mol-1,化学键为b KJ·mol-1,氢键为c KJ·mol-1,则a、b、c的大小关系是
A.a>b>c B.b>a>c C.c>b>a D.b>c>a
难度: 中等查看答案及解析
-
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( HO
CHO )之间存在氢键(分子间氢键)。则两者的熔点、沸点的相对大小关系是
A.前者>后者 B.前者<后者 C.前者=后者 D.无法估计
难度: 中等查看答案及解析
-
根据等电子原理,下列分子或离子与SO42-有相似结构的是
A.PCl5 B.CCl4 C.NF3 D.N
难度: 中等查看答案及解析
-
下列说法正确的是
A.在元素周期表中,每个纵列的价电子层的电子总数一定相等
B.在元素周期表中,s区,d区和ds区的元素都是金属
C.键能是气态基态原子形成化学键释放的最低能量
D.键长越长,往往键能越大,表明共价键越稳定
难度: 中等查看答案及解析
-
人们在研究金星大气成分,发现金星大气中有一种称之为硫化羟(COS)的分子,其结构与CO2类似,硫化羟是一种与生命密切相关的物质。下列有关COS的推测肯定不正确的是
A、COS属于离子化合物 B、COS分子中,所有原子都满足8电子的稳定结构
C、COS的结构式为O=C—S D、COS含有共价键
难度: 中等查看答案及解析
-
已知次氯酸分子的结构式为H—O—Cl,下列有关说法正确的是
A、次氯酸为非极性共价化合物 B、O原子与H、Cl都形成σ键
C、该分子为直线型分子 D、该分子的电子式是H︰O︰Cl
难度: 中等查看答案及解析
-
下列有机物分子中带“*”碳原子就是手性碳原子。
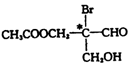
该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是
A.与乙酸发生酯化反应 B.与NaOH水溶液反应
C.与银氨溶液作用只发生银镜反应 D.催化剂作用下与H2反应
难度: 中等查看答案及解析
-
下列电子排布式中,原子处于激发状态的是
A.1s22s22p5 B.1s22s22p43s2
C.1s22s22p63s23p63d44s2 D.1s22s22p63s23p63d34s2
难度: 中等查看答案及解析
-
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是
A.氯化硼液态时能导电而固态时不导电
B.氯化硼中心原子采用sp杂化
C.氯化硼分子呈正三角形,属非极性分子
D.其分子空间结构类似CH2O
难度: 中等查看答案及解析