-
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
难度: 简单查看答案及解析
-
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
难度: 中等查看答案及解析
-
从光合作用的反应原理6CO2+6H2O
C6H12O6+6O2可知碳是农作物生长的必需元素之一。关于用二氧化碳生产肥料的评价正确的是
A.缓解地球温室效应,抑制农作物营养平衡
B.加剧地球温室效应,促进农作物营养平衡
C.缓解地球温室效应,促进农作物营养平衡
D.加剧地球温室效应,抑制农作物营养平衡
难度: 简单查看答案及解析
-
下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. HClO3和K2SO4 D. Na2SO3和BaCO3
难度: 简单查看答案及解析
-
下列有关化学用语能确定为丙烯的是

难度: 简单查看答案及解析
-
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(S)+ H2(g)
2HI(g) - 26.48 kJ
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 简单查看答案及解析
-
下列叙述正确的是
A.1.00mol NaCl中含有6.02×1023个NaCl分子
B.1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配制1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
难度: 简单查看答案及解析
-
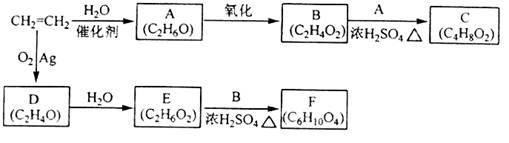
分子式为
的同分异构体共有(不考虑立体异构)
A.6种 B.7种 C.8种 D.9种
难度: 简单查看答案及解析
-
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2
CH3CHBrCH2Br
②CH3CH2OH
CH2=CH2+H2O
③CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
④C6H6+HNO3
C6H5NO2+H2O
A. ①② B. ③④ C. ①③ D. ②④
难度: 简单查看答案及解析
-
设NA是阿伏伽德罗常数的数值,下列说法正确的是
A.1molAl3+离子含有的核外电子数为3NA
B.1molCl2与足量的铁反应,转移的电子数为3NA
C.10LpH=1的硫酸溶液中含有的H+离子数为2NA
D.10LpH=13的NaOH溶液中含有的OH-离子数为NA
难度: 简单查看答案及解析
-
某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100kJ·mol-1
B.逆反应活化能一定小于100kJ·mol-1
C.正反应活化能不小于100kJ·mol-1
D.正反应活化能比逆反应活化能大100kJ·mol-1
难度: 简单查看答案及解析
-
.能正确表示下列反应的离子方程式为
A. 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C. 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3-
D. 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
难度: 简单查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D. 元素Z可与元素X形成共价化合物XZ2
难度: 简单查看答案及解析
-
一种充电电池放电时的电极反应为
H2+2OH—2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是
A. H2O的还原 B. NiO(OH)的还原
C. H2的氧化 D. NiO(OH) 2的氧化
难度: 简单查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是

难度: 简单查看答案及解析
-
浓硫酸有许多重要的性质,在与含有永分的蔗糖作用过程中不能显示的性质是
A.酸性 B.脱水性 C.强氧化性 D.吸水性
难度: 简单查看答案及解析
-
下列溶液中通入SO2一定不会产生沉淀的是
A. Ba(OH)2 B. Ba(NO3)2 C. Na2S D. BaCl2
难度: 简单查看答案及解析
-
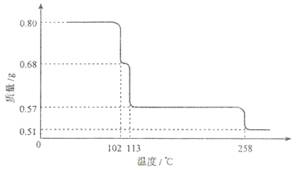
草酸晶体(H2C2O4·2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)
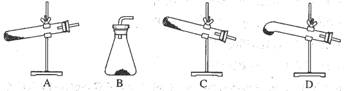
难度: 简单查看答案及解析
-
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(S)+ H2(g)
2HI(g) - 26.48 kJ
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 简单查看答案及解析
-
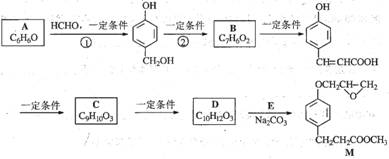
甲醛与亚硫酸氢钠的反应方程式为HCHO+NaHSO3
HO-CH2-SO3Na,反应产物俗称“吊白块”。关于“吊白块”的叙述正确的是
A.易溶于水,可用于食品加工 B.易溶于水,工业上用作防腐剂
C.难溶于水,不能用于食品加工 D.难溶于水,可以用作防腐剂
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列叙述正确的是
A. 煤的干馏和石油的分馏均属化学变化
B. BaSO4在医学上用作钡餐,BaSO4对人体无毒
C. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
D.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
难度: 简单查看答案及解析
-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中以化合态的形式存在 B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应 D.气态氢化物比甲烷稳定
难度: 简单查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下能水解
C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 简单查看答案及解析
-
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al
难度: 简单查看答案及解析
-
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均以此增强
D.元素周期表中位于金属和非金属非界线附近的元素属于过渡元素
难度: 简单查看答案及解析
-
室温下向10 mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
难度: 简单查看答案及解析
-
.以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后对铁制品失去保护作用
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+==Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O==NO3-+NO+2H+
C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+==Ca2++H2O+CO2↓
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O==2A(OH)3↓+CO32-
难度: 简单查看答案及解析
-
常温下,下列各组离子在制定溶液中一定能大量共存的是
A.1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I-3
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 简单查看答案及解析