-
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 困难查看答案及解析
-
下列关于化学键的说法正确的是( )
A.构成单质分子的微粒一定含有共价键
B.全部由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里的化学键一定都是极性键
难度: 中等查看答案及解析
-
把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极。则这四种金属的活动性顺序由大到小为( )
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
关于吸热反应和放热反应,下列说法错误的是( )
A.需要加热才能进行的化学反应一定是吸热反应
B.化学反应中的能最变化,除热量外,还可以是光能、电能等
C.化学反应过程中的能量变化,也服从能量守恒定律
D.反应物的总能量高于生成物的总能量时,发生放热反应
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
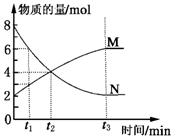
A.反应的化学方程式为:2M
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
设C+CO2
2CO(正反应吸热),反应速率为v1;N2+3H2
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
难度: 简单查看答案及解析
-
某元素X最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中X元素的化合价为( )
A.5n-2 B.3n-12 C.3n-6 D.n-10
难度: 简单查看答案及解析
-
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为:Pb+PbO2+2H2SO4
=2PbSO4+2H2O,下列结论正确的是( )
A.Pb为正极被氧化 B.溶液的pH不断减小
C.SO42-只向PbO2处移动 D.电解质溶液pH不断增大
难度: 中等查看答案及解析
-
下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.沸点:H2O>HF>HCl>HBr
C.稳定性:PH3<H2S<HCl
D.非金属性:F>O>S
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C2->D->B+>A2+
D.单质的还原性:A>B>D>C
难度: 简单查看答案及解析
-
下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
难度: 中等查看答案及解析
-
一定温度下,向aL密闭容器中加入2molNO2气体,发生如下反应:2NO2(g)
2NO(g)+O2(g),此反应达到平衡状态的标志是( )
A.混合气体的密度不再变化
B.混合气休的颜色不变化
C.混合气体中NO2、NO、O2的物质的量之比为2:2:1
D.单位时间生成2nmolNO,同时消耗2nmolNO2
难度: 中等查看答案及解析
-
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)
2C(g)反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A 的转化率为( )
A.40% B.50% C.60% D.70%
难度: 中等查看答案及解析
-
A、B两元素为某周期IIA族和ⅢA族元素,若A元素的原子序数为m,则B元素的原子序数可能为( )
① m+l ②m+81 ③m+11 ④m+18 ⑤m+25 ⑥m+32
A.①③⑥ B.①③⑤ C.②④⑤ D.②④⑥
难度: 中等查看答案及解析
-
下列一定是放热反应的是( )
A.氧化还原反应 B.离子反应 C.复分解反应 D.缓慢氧化
难度: 简单查看答案及解析
-
对
的叙述正确的是( )
A.有两种结构 B.只有一种结构 C.含有非极性键 D.有四种结构
难度: 简单查看答案及解析
-
在密闭的容器中进行X2(g)+3Y2(g)=2Z2(g),若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,当反应达到平衡后各物质的浓度不可能是( )
A.X2为0.1mol/L B.X2为0.2mol/L
C.Z2为0.3mol/L D.Z2为0.8mol/L
难度: 中等查看答案及解析
-
已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1mol氢气的化学键消耗的能量为Q1kJ,破坏1mol氯气的化学键消耗的能量为 Q2kJ ,破坏1mol氯化氢中的化学键消耗的能量为Q3kJ,下列关系式最准确的是( )
A.Q1 + Q2 > Q3 B.Q1 + Q2 > 2Q3
C.Q1 + Q2 < Q3 D.Q1+ Q2 < 2Q3
难度: 中等查看答案及解析
-
A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是( )
A.原子序数:A>C>B>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
难度: 中等查看答案及解析
-
下列有关物质结构和性质的说法中,正确的是( )
A.因为水溶液的酸性:HCl>H2S,所以非金属性:Cl>S
B.同周期第IIA族与第ⅢA族的元素原子序数之差不一定为1
C.元素原子的最外层电子数越多,越容易得电子,非金属性越强
D.同周期主族元素的原子形成的简单离子电子层结构相同
难度: 中等查看答案及解析
-
下图是元素周期表中短周期的一部分,B、C、D、F四种元素的原子核外最外层电子数之和等于C、D元素的原子序数之和。下列说法不正确的是( )
A.B元素形成的气态氢化物分子的空间结构是三角锥形
B.气态氢化物的稳定性C>E的原因是C分子间存在氢键
C.EF2分子中各原子的最外层均满足8电子稳定结构
D.A的单质均能溶于热的B或E的最高价氧化物的水化物的浓溶液中
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
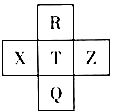
A.非金属性:Z<T<X B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q D.最高价氧化物的水化物的酸性:T<Q
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A(s)+2B(g)
C(g)+D(g) 已达平衡的是( )
A.混合气体的密度 B.混合气体的压强
C.A的物质的量浓度 D.气体的总物质的量
难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.通常情况下,甲烷跟强酸、强碱、强氧化剂不反应
B.甲烷化学性质比较稳定,不能被任何氧化剂氧化
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHC13还是CCl4,都是取代反应
D.常温下CH3Cl为气体
难度: 中等查看答案及解析
-
下列各分子中所有原子都满足最外层为8电子结构的是( )
A.BeC12 B.PC13 C.PCl5 D.NH3
难度: 中等查看答案及解析
-
X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布。X元素单质能在氢气中燃烧,产生苍白色火焰;Y元素氢化物的分子式是H2Y,其最高氧化物含有40%的Y;Z元素的离子具有紫色的焰色反应。
(1)根据以上条件,推断元素名称:X:_____,Y:_____,Z:________。
(2)X、Y、Z最高价氧化物对应的水化物的酸性由强到弱的顺序是________。
(3)用电子式表示Z2Y的形成过程:___________,其化合物中化学键的类型是________。
难度: 中等查看答案及解析