-
下列物质属于电解质的是( )
A.石墨
B.烧碱
C.蔗糖
D.金属铝难度: 中等查看答案及解析
-
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A.硫酸、硫酸铜、纯碱
B.水、空气、纯碱
C.醋酸、空气、生石灰
D.硝酸、食盐水、烧碱难度: 中等查看答案及解析
-
选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu
B.稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑
C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑难度: 中等查看答案及解析
-
从1L1mol/LNaOH溶液中取出100ml,下列关于这100ml溶液的叙述中错误的是( )
A.含NaOH0.1mol
B.浓度为1mol/L
C.含NaOH4g
D.浓度为0.1mol/L难度: 中等查看答案及解析
-
关于粗盐提纯的下列说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.将制得晶体转移到新制过滤器中用大量水进行洗涤难度: 中等查看答案及解析
-
下列现象与胶体的性质无关的是( )
A.将盐卤或石膏加入豆浆,制成豆腐
B.一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象难度: 中等查看答案及解析
-
下列液体中,不会出现丁达尔效应的分散系是( )
(1)鸡蛋清溶液;(2)水;(3)淀粉溶液;(4)硫酸钠溶液;(5)沸水中滴入饱和FeCl3溶液.
A.(2)(4)
B.(3)(4)
C.(2)(4)(5)
D.(4)难度: 中等查看答案及解析
-
下列有关0.2mol/L氯化钡溶液的说法不正确的是( )
A.500mL溶液中Cl-离子浓度为0.2mol•L-
B.500mL溶液中Ba2+离子浓度为0.2mol•L-
C.500mL溶液中Cl-离子总数为0.2NA
D.500mL溶液中Ba2+和Cl-离子总数为0.6NA难度: 中等查看答案及解析
-
设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
A.1molNH3所含有的氢原子数为3NA
B.常温常压下,22.4L氧气所含的原子数为2NA
C.常温常压下,48gO3所含的氧原子数为3NA
D.1L0.1mol/LNaCl溶液中所含的Na+为NA难度: 中等查看答案及解析
-
有关化学实验的下列操作中,一般情况下须相互接触的是( )
A.蒸馏操作中,温度计与烧瓶中的液体
B.过滤操作中,漏斗颈与烧杯内壁
C.分液操作中,分液漏斗颈与烧杯内壁
D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁难度: 中等查看答案及解析
-
相同质量的镁和铝所含原子个数比为( )
A.1:1
B.8:9
C.9:8
D.2:3难度: 中等查看答案及解析
-
与1.8g H2O含有相同氧原子数的H2SO4为( )
A.2.45g
B.4.9g
C.0.1g
D.0.2g难度: 中等查看答案及解析
-
欲配制100ml 1.0mol/L Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100ml水中
②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100ml
③将20ml 5.0mol/L Na2SO4溶液用水稀释至100ml.
A.①②
B.②③
C.①③
D.①②③难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.CO2的摩尔质量为44g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L难度: 中等查看答案及解析
-
如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )
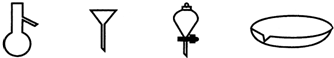
A.蒸馏、蒸发、萃取、过滤
B.萃取、过滤、蒸馏、蒸发
C.蒸馏、过滤、萃取、蒸发
D.过滤、蒸发、萃取、蒸馏难度: 中等查看答案及解析
-
同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的( )
A.质量
B.原子总数
C.碳原子数
D.密度难度: 中等查看答案及解析
-
30mL1mol/LNaCl溶液和40mL0.5mol/LCaCl2溶液混合之后(体积的变化忽略不计),混合液中Cl-的物质的量浓度为( )
A.0.5mol/L
B.0.6mol/L
C.1mol/L
D.2mol/L难度: 中等查看答案及解析
-
在标准状况下,将wgA气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )mol/L.
A.
B.
C.
D.难度: 中等查看答案及解析
-
标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③5.6g CH4 ④0.5mol HCl,下列关系正确的是( )
A.体积大小:④>③>①>②
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①难度: 中等查看答案及解析