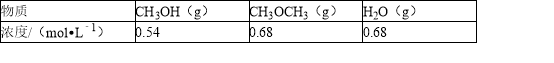
-
化学与能源开发、环境保护、生产生活等密切相关。下列说法正确的是
A.开发利用可燃冰是缓解能源紧缺的唯一途径
B.将废电池深埋,可以避免其中的重金属污染
C.“地沟油”对人体的危害极大,严禁用做食用油
D.食品保鲜膜、食品袋的主要成分都是聚氯乙烯
难度: 中等查看答案及解析
-
下列物质分类组合正确的是
A
B
C
D
强电解质
HBr
FeCl3
H3PO4
Ca(OH)2
弱电解质
HF
CH3COOH
BaSO4
HI
非电解质
NH3
Cu
H2O
C2H5OH
难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
B.一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣38.6 kJ/mol
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol
D.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
难度: 困难查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性
B.水的离子积变大、pH变小、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积不变、pH不变、呈中性
难度: 简单查看答案及解析
-
250 ℃和1.01×105 Pa时,反应2N2O5(g) == 4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
难度: 中等查看答案及解析
-
H2S溶液中,在采取措施使pH增大的同时,则c(S2﹣)的变化情况是
A.增大 B.减小
C.不变 D.可能增大,也可能减小
难度: 简单查看答案及解析
-
常温下a mol•L﹣1稀氨水和b mol•L﹣1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A.若a=b,则c(NH4+)=c(Cl﹣)
B.若a>b,则c(NH4+)>c(Cl﹣)
C.若a>b,则c(OH﹣)>c(H+)
D.若a<b,则c(OH﹣)<c(H+)
难度: 中等查看答案及解析
-
将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:
2A(g)+3B(g)
2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:
v(D)=0.25 mol/(L·min),则下列推断正确的是
A.v(C)=0.2 mol/(L·min) B.z=3
C.B的转化率为25% D.C的体积分数约为28.6%
难度: 困难查看答案及解析
-
使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是
A.用量筒量取浓盐酸配制0.1mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸
B.配制稀盐酸定容时,俯视容量瓶刻度线
C.滴定前尖嘴处无气泡,滴定终点时有气泡
D.滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能大量共存的是
A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl﹣、NO3﹣
B.c(H+)=10﹣12 mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣
C.c(OH﹣)/c(H+)=1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
D.由水电离的c(H+)=1.0×10﹣13 mol•L﹣1的溶液中:K+、NH4+、AlO2﹣、HCO3﹣
难度: 困难查看答案及解析
-
对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )
A.
B.
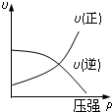
C.
D.
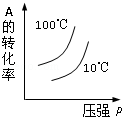
难度: 中等查看答案及解析
-
将固体A置于密闭容器中,在一定温度下发生下列反应:
①A(s)
B(g)+C(g);②2C(g)
D(g)+E(g)。
达到平衡时,c(D)=0.5mol·L-1,c(C)=4mol·L-1,则此温度下反应①的平衡常数为
A.25 B.20 C.16 D.9
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a > c+d
难度: 中等查看答案及解析
-
如图表示水中c(H+)和c(OH﹣)的关系,下列判断错误的是
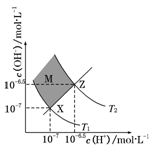
A.两条曲线间任意点均有c(H+)×c(OH﹣)=KW
B.XZ线上任意点均有pH=7
C.图中T1<T2
D.M区域内任意点均有c(H+)<c(OH﹣)
难度: 困难查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH﹣)>c(A﹣)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na2CO3)<c(CH3COONa)<c(NaOH)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO﹣)+2c(OH﹣)=2c(H+)+c(CH3COOH)
D.0.1mol•L﹣1的NaHA溶液,其pH=4:c(HA﹣)>c(H+)>c(H2A)>c(A2﹣)
难度: 极难查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
2NH3(g) △H=﹣92.4 kJ/mol)
容器
甲
乙
丙
反应物投入量
1mol N2、3mol H2
2mol NH3
4mol NH3
NH3的浓度(mol·L-1)
c1
c2
c3
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
下列说法正确的是
A.
B.
C.
D.α1+α2﹥1
难度: 困难查看答案及解析