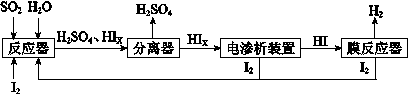
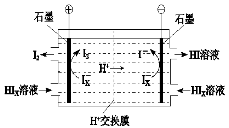
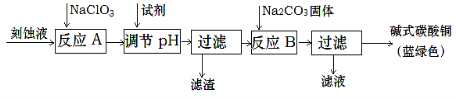
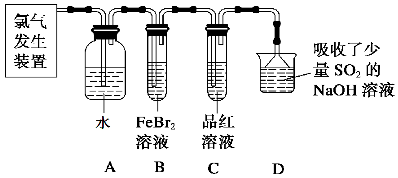
-
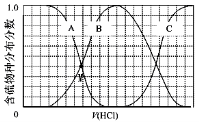
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.导致青岛开发区石油管线爆炸的非甲烷总烃在日光照射下会产生光化学烟雾
B.塑化剂是一种应用很广的化工塑料软化剂,可大量添加到婴幼儿玩具中
C.航天员太空实验能够证明水分子组成和结构在太空中发生改变
D.汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物
难度: 中等查看答案及解析
-
A、B、C是原子序数依次增大的短周期元素,A元素某种同位素原子在考古方面有重要应用,B的最外层电子是电子层数的三倍,C的焰色反应呈黄色,下列说法正确的是
A.元素A在周期表中的位置为第2周期VIA族
B.元素A、B、C的原子半径由大到小的顺序为r(C) > r(B) > r(A)
C.A、B两种元素的氢化物的稳定性A>B
D.1 molC2B2与足量的AB2完全反应转移约6.02 ×1023个电子
难度: 中等查看答案及解析
-
有关物质性质及用途的说法,正确的是
A.甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
B.将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应
C.牡丹籽油是一种优良的植物油脂,它可使酸性高锰酸钾溶液褪色
D.等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等
难度: 中等查看答案及解析
-
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
A.滴加KI溶液时,KI被氧化,CuI是还原产物
B.通入SO2后,溶液变无色,体现SO2的还原性
C.整个过程发生了复分解反应和氧化还原反应
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 中等查看答案及解析
-
用下表提供的仪器和药品,能达到实验目的的是
编号 仪器 药品 实验目的
A 烧杯、分液漏斗、胶头滴管、铁架台 待提纯的AlCl3溶液、NaOH溶液 提纯混有MgCl2杂质的AlCl3溶液
B 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 盐酸、大理石、
碳酸钠溶液 证明非金属性:Cl>C>Si
C 酸式滴定管、胶头滴管、铁架台(带铁夹) 已知浓度的盐酸、
待测NaOH溶液 测定NaOH溶液的物质的量浓度
D 酒精灯、玻璃棒、
蒸发皿、铁架台(带铁圈) NaCl溶液 蒸发溶液得到晶体
难度: 中等查看答案及解析
-
通过NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法不正确的是
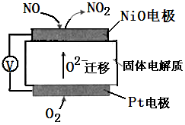
A.Pt电极是该装置的正极
B.该电池发生的正极反应为:O2 + 4e− + 2H2O = 4OH−
C.负极的电极反应式:NO−2e−+O2−= NO2
D.固体电解质中O2−向负极移动
难度: 中等查看答案及解析
-
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
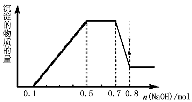
A.溶液中一定不含CO32−,可能含有SO42−和NO3−
B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3+ +4OH- =[Al(OH)4 ]-
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1
难度: 中等查看答案及解析
-
某课题小组合成了一种复合材料的基体M的结构简式为
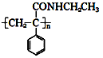 ,合成路线如下
,合成路线如下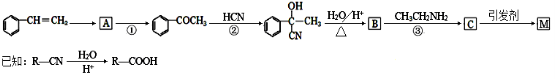
请回答下列问题:
(1)有机物C分子结构中含有的官能团有 。
(2)写出A的结构简式 。
(3)反应①、②的反应类型分别为 、 。
(4)写出反应③的化学方程式 。
(5)写出符合下列条件:①能使FeCl3溶液显紫色;②只有二个取代基;③与新制的Cu(OH)2悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 。
难度: 中等查看答案及解析