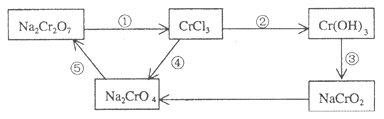
-
实验室中可用如下反应制取氯气:2KMnO4 + 16HCl (浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O,此反应中氧化剂与还原剂的物质的量之比为
A.1︰8 B.5︰2 C.1︰5 D.5︰1
难度: 中等查看答案及解析
-
下列类型的反应,一定发生电子转移的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 中等查看答案及解析
-
下列物质中属于强电解质且能导电的是
①氢氧化钠溶液 ②硫酸钙固体 ③铜 ④蔗糖 ⑤三氧化硫 ⑥熔融氯化钠
A.①②⑤ B.①②⑥ C.③⑥ D.⑥
难度: 中等查看答案及解析
-
下列溶液里离子检验的结论正确的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入足量稀盐酸,溶液无现象,再加入氯化钡溶液后有白色沉淀产生,一定有SO42-
D.加入稀盐酸产生无色气体,气体通入澄清石灰水,溶液变浑浊,一定有CO32-
难度: 中等查看答案及解析
-
从化学试剂商店买来的无水乙醇试剂瓶上所贴的危险化学品标志是
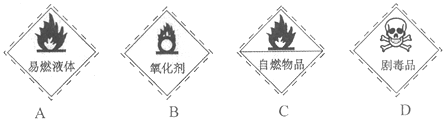
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A.
=
B.
·
=
+OH
C.
=
D.
难度: 简单查看答案及解析
-
下列说法中正确的是
A.
的摩尔质量是44g
B.
的摩尔质量是60g/mol
C. 1mol
的质量是32g/mol
D. 铁的摩尔质量就是铁的相对原子质量
难度: 简单查看答案及解析
-
下列关于胶体的叙述中,不正确的是
A. 用半透膜除去淀粉胶体中的NaCl溶液
B. 胶体中分散质粒子的直径小于1 nm
C. 利用丁达尔效应可以区分溶液和胶体
D. 用滤纸能分离胶体和悬浊液
难度: 简单查看答案及解析
-
将10 mL 5 mol/L 的HCl溶液稀释到 200 mL,从中取出5 mL,这5 mL溶液的物质的
量浓度为
A、0.5 mol/L B、0.25 mol/L C、0.1 mol/L D、1 mol/L
难度: 中等查看答案及解析
-
下列说法正确的是
A.氧化还原反应的本质是电子的转移
B.化合反应一定是氧化还原反应
C.物质中某元素失去电子,则此物质是氧化剂
D.离子反应可能是复分解反应,但一定不是氧化还原反应
难度: 中等查看答案及解析
-
下列变化中,需加入适当的还原剂才能完成的是
A. KI→I
B. FeCl
→FeCl
C. CuO→Cu D. CO
→Na
CO
难度: 中等查看答案及解析
-
下列关于化学实验基本操作的叙述中,正确的是
A. 加热蒸发时,蒸发皿必须垫石棉网
B. 制Fe(OH)3胶体时,将饱和FeCl3溶液加热煮沸
C. 分液时,放出分液漏斗下层液体后,再继续放出上层液体
D. 蒸馏时,在烧瓶中加入沸石或碎瓷片,以防止液体暴沸
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是
A. 在无色溶液中:
、
、
、
B. 在含大量
的溶液中:
、Na
、
、
C. 在强碱溶液中:Na
、K
、
、
D. 在pH=1的溶液中:K
、
、
、
难度: 中等查看答案及解析
-
下列离子方程式改写成化学方程式正确的是
A.
+
=
↓
B.
C.
D.
难度: 中等查看答案及解析
-
下列反应的现象描述与离子方程式都正确的是
A. 锌片插入硝酸银溶液中,有银析出:
B. 氢氧化钡溶液与稀硫酸反应,有白色沉淀生成:
C. 氢氧化铜加到盐酸中, 无明显现象:
D. 碳酸钡中加入稀盐酸,固体溶解,生成无色无味气体:
难度: 中等查看答案及解析
-
用
表示阿伏加德罗常数,下列说法中正确的是
A. 在常温常压下,11.2L氯气所含的原子数目为
B. 32g氧气含的原子数目为
C. 5.6g铁与足量盐酸反应转移的电子数为0.2
D. 2 L 0.1mol·L
溶液中离子总数约为1.4
难度: 中等查看答案及解析
-
下列物质的分离方法不正确的是
A. 用过滤的方法除去粗盐溶液中的泥沙
B. 用加热法除去CaO中少量的
C. 用酒精萃取碘水中的碘
D. 用水冲洗的方法从沙里淘金
难度: 中等查看答案及解析
-
下列实验装置与实验目的对应的是

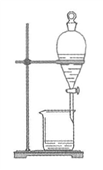

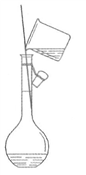
A. 用海水制蒸馏水
B. 将碘水中的碘单质与水直接分离
C. 除去
胶体中的
D. 稀释浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
关于同温同压下等体积的CO2和CO,下列叙述:①质量相等;②密度相等;③所含分子数相等;④所含碳原子数相等,其中正确的是( )
A.①②③④ B.②③④ C.③④ D.③
难度: 中等查看答案及解析
-
硫酸钾和硫酸铁的混合溶液,已知其中
的浓度为0.5 mol/L,硫酸根离子浓度为0.9 mol/L,则
的物质的量浓度为
A. 0.1 mol/L B. 0.15 mol/L C. 0.3 mol/L D. 0.2 mol/L
难度: 简单查看答案及解析
-
下列反应转化关系(未配平)肯定不正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
实验过程中,下列溶液的导电能力变化不大的是
A.
溶液中滴入
溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水中通入
至过量
D.
溶液中加入适量的NaOH固体
难度: 中等查看答案及解析