-
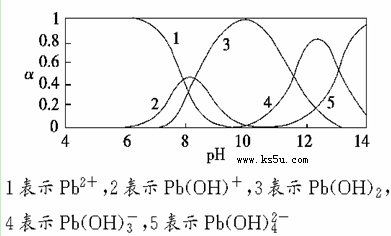
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
难度: 困难查看答案及解析
-
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A.硫酸与氢氧化钡中和:H+ + OH- = H2O
B.碳酸氢钠的水【解析】
HCO3-+ H2OH3O+ + CO32-
C.碳酸钠的水【解析】
CO32-+2H2OH2O+ CO2+2OH-
D.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3 NH4+
难度: 中等查看答案及解析
-
下列物质的核磁共振氢谱图中,有5个吸收峰的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列说法正确的是
A.某有机物含有C、H、O、N四种元素,其球棍模型为
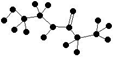 。该有机物的结构简式为
。该有机物的结构简式为B.按系统命名法,化合物
的名称为3-甲基-2-乙基己烷
C.七叶内酯(
)和东莨菪内酯(
)都是某些中草药中的成分,它们具有相同的官能团,互为同系物
D.S-诱抗素的结构简式为:
,则1 mol S-诱抗素与氢氧化钠溶液反应时,最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
乙醇分子结构中各种化学键如下所示,关于乙醇在各种反应中断键的说明不正确的为
A.和乙酸共热时,断裂①键
B.和金属钠反应时,键①断裂
C.和P2O5共热时,键②⑤断裂
D.在铜催化下和氧气反应时,键①⑤断裂
难度: 中等查看答案及解析
-
下列实验能达到目的的是



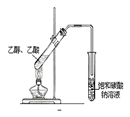
A.证明酸性:盐酸>碳酸>苯酚 B.石油蒸馏
C.实验室制硝基苯 D.实验室制乙酸乙酯
难度: 中等查看答案及解析
-
有A、B两种烃,所含碳元素的质量分数相同,关于A和B叙述中正确的是
A.二者不可能是同系物
B.二者一定是同分异构体
C.二者最简式相同
D.各1mol的A和B分别燃烧生成CO2的质量一定相等
难度: 中等查看答案及解析
-
某地高速公路上一辆运送化学物品的槽罐车侧翻,罐内15 t苯泄入路边300 m长的水渠,造成严重危险,许多新闻媒体进行了连续报道,以下报道中有科学性错误的是
A.苯有毒,大量苯溶入水中渗入土壤,会对周边农田、水源造成严重污染
B.苯是一种易挥发、易燃的物质,周围地区如果有火星就可能引起爆炸
C.有人提出可以采取抽吸水渠中上层液体的办法,达到清除泄漏物的目的
D.处理事故时,由于事故发生地周围比较空旷,有人提出用点火焚烧的办法来清除泄漏物,但由于苯燃烧会产生大量的黑烟污染空气,所以该办法未被采纳
难度: 中等查看答案及解析
-
结构为
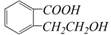 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:①
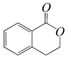 ②
②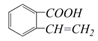 ③
③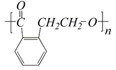 ④
④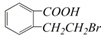 ,
,生成这四种有机物的反应类型依次为:
A.取代、消去、酯化、加成 B. 酯化、消去、缩聚、取代
C.酯化、取代、缩聚、取代 D.取代、消去、加聚、取代
难度: 中等查看答案及解析
-
经检验,“毒豆芽”中含有一种动物用药恩诺沙星,其分子结构如下图所示,下列有关恩诺沙星说法不正确的是

A.不溶于水,微溶于甲醇,可溶于酸和碱
B.分子式为C19H22FN3O3
C.该物质能发生酯化、加成、氧化、硝化、缩聚反应
D.该物质的一氯代物共有9种
难度: 中等查看答案及解析
-
25℃时,将稀氨水逐滴滴加到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)=c(SO42-)
B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-)
D.c(NH4+)+c(SO42-)=c(H+)=c(NH4+)
难度: 中等查看答案及解析
-
常温下,将甲酸与NaOH溶液混合,所得溶液的pH=7,则此溶液中( )
A.c(HCOO-)>c(Na+)
B.c(HCOO-)<c(Na+)
C.c(HCOO-)= c(Na+)
D.无法确定c(HCOO-)与c(Na+)的关系
难度: 中等查看答案及解析
-
在0.1mol/L的醋酸溶液中,存在平衡:CH3COOH
CH3COO- +H+ 下列说法正确的是( )
A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大
B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小
C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小
D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大
难度: 中等查看答案及解析
-
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )

A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
难度: 中等查看答案及解析
-
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
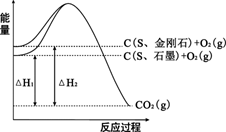
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石) △H =+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
难度: 中等查看答案及解析
-
等物质的量浓度的下列溶液中,c(
)最大的是( )
A.NH4HCO3 B.NH4NO3 C.(NH4)2CO3 D.NH4HSO4
难度: 中等查看答案及解析
-
温度压强一定,在催化剂铁触媒作用下,向一密闭容器充入N2、H2和NH3 。若起始时n(N2)=x mol、n(H2)=y mol、n(NH3)=z mol (x、y、z均不为0 ),平衡时n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是:
A.N2、H2的转化率不相等 B.平衡时,H2与NH3的生成速率之比为3:2
C.x : y =1:3 D.x的取值范围为0<x<0.14
难度: 中等查看答案及解析
-
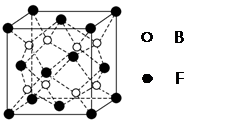
下列说法中正确的是
A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度
难度: 中等查看答案及解析
-
1911年前后,英国物理学家卢瑟福用带正电的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子的运动轨迹,能正确反映实验结果的图是( )

难度: 简单查看答案及解析