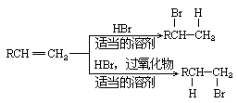
-
古代药学著作《本草经集注》共七卷,其中对“消石”的注解如下:“… 如握雪不冰。强烧之,紫青烟起,仍成灰…”。这里的“消石”是指
A. 氢氧化钙 B. 硝酸钾 C. 高锰酸钾 D. 硝酸钠
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA
B. 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子
C. 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA
D. 100g 46%的乙醇溶液中,含H-O键的数目为NA
难度: 中等查看答案及解析
-
杨树生长迅速,高大挺拔,树冠有昂扬之势。其体内有一种有机物,结构如下图所示。下列说法错误的是( )
A. 该有机物属于烃的衍生物
B. 分子式为C14H14O2
C. 1 mol该物质与溴水反应时最多能消耗2 mol的Br2
D. 该有机物能与Na2CO3溶液反应,且生成的气体能使澄清石灰水变浑浊
难度: 中等查看答案及解析
-
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项
实验
现象
结论
A
25℃,两片相同的Al片分别和等体积稀HNO3和浓HNO3反应
前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈
其他条件相同时,反应物浓度越大,反应速率越快
B
将无水乙醇和浓H2SO4的混合物加热至170℃,产生的气体通入酸性KMnO4溶液
KMnO4溶液紫红色褪去
乙烯具有还原性
C
SO2通入BaCl2溶液,然后滴入稀硝酸
有白色沉淀产生,加入稀硝酸后沉淀不溶解
所得沉淀为BaSO3,后转化为BaSO4
D
向盛有AgCl固体试管中加入一定量的0.01mol•L-1 KI溶液
固体由白色逐渐变为黄色
Ksp(AgCl)>Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据下图回答,下列说法错误的是( )
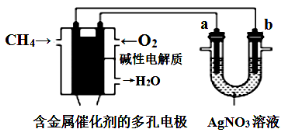
A. 电子经导线流入b电极
B. 若b极增重5.4 g时,燃料电池负极消耗CH4的体积为140 mL
C. 燃料电池中正极反应为O2+4e-+2H2O = 4OH-
D. 此装置用于电镀银时,一段时间后硝酸银溶液的浓度不变
难度: 中等查看答案及解析
-
常温下,向20 mL 0.1 mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
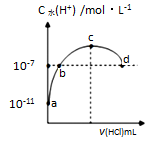
则下列说法正确的是
A. 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
难度: 困难查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是

A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
难度: 困难查看答案及解析