-
现有三种元素的基态原子的电子排布式:①1s22s22p63s23p4;②ls22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A. 第一电离能:③>②>①
B. 原子半径:③>②>①
C. 电负性:③>②>①
D. 最高正化合价:③>②>①
难度: 简单查看答案及解析
-
下列表达方式错误的是
A. 甲烷的电子式
B. 氟化钠的电子式
C. 硫离子的核外电子排布式 1s22s22p63s23p4
D. 碳12原子612C
难度: 中等查看答案及解析
-
已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
A. 第三周期VIII族,P区
B. 第三周期VB族,ds区
C. 第四周期VIII族,d区
D. 第四周期VB族, f区
难度: 简单查看答案及解析
-
下面的排序不正确的是( )
A. 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 B. 键角由大到小:CO2>BF3> H2O > NH3
C. 硬度由大到小:金刚石>碳化硅>晶体硅 D. 晶格能由大到小: NaF> NaCl> NaBr>NaI
难度: 中等查看答案及解析
-
向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A. [Co(NH3)3Cl3] B. [Co(NH3)6]Cl3
C. [Co(NH3)4Cl2]Cl D. [Co(NH3)5Cl]Cl2
难度: 中等查看答案及解析
-
在氯化钠晶体晶胞中,与某个Na+距离最近且等距的几个Cl-所围成的空间构型为( )
A. 正四面体形 B. 正八面体形
C. 正六面体形 D. 三角锥形
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 气体单质中,一定有σ键,可能有π键
B. 基态C原子有两个未成对电子,所以最多只能形成2个共价键
C. 1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性所决定的
D. 所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
难度: 中等查看答案及解析
-
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的( )
A. 2Na2O2+2H2O=4NaOH+O2↑
B. Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C. Cl2+H2O=HClO+HCl
D. NH4Cl+NaOH
NaCl+NH3↑+H2O
难度: 简单查看答案及解析
-
关于氢键,下列说法中,正确的是 ( )
A. 氢键比范德华力强,所以它属于化学键
B. 分子间形成的氢键使物质的熔点和沸点升高
C. 含氢原子的物质之间均可形成氢键
D. H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数)
A. 124gP4含有P—P键的个数为4NA
B. 12g石墨中含有C—C键的个数为3NA
C. 12g金刚石中含有C—C键的个数为2NA
D. 60gSiO2中含Si—O键的个数为2NA
难度: 简单查看答案及解析
-
氮化碳结构如下图所示,其硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是 ( )
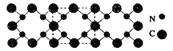
A. 氮化碳属于原子晶体
B. 氮化碳中碳显-4价,氮显+3价
C. 氮化碳的化学式为C3N4
D. 每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
难度: 中等查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
现代无机化学对硫一氮化合物的研究是最为活跃的领域之一。如图是已经合成的最著名的硫—氮化合物的分子结构,下列说法正确的是
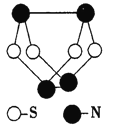
A. 该物质的分了式为SN
B. 该物质的分子中既含有极性键又含有非极性键
C. 该物质具有很高的熔、沸点
D. 该物质与化合物S2N2互为同素异形体
难度: 中等查看答案及解析
-
下列说法中,均正确的一组是( )
①两种元素组成的共价化合物的分子中的化学键都是极性键
②两种不同非金属元素的原子之间形成的化学键都是极性键
③分子晶体中相对分子质量越大则熔沸点就越高
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤离子化合物中一定含有离子键
⑥分子内可能没有共价键
⑦原子晶体中一定有非极性共价键
A. 只有②⑤⑥⑦ B. 只有②⑤⑥ C. 只有①②⑤⑥ D. 只有①②③⑤⑥⑦
难度: 中等查看答案及解析
-
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
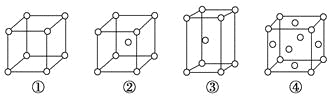
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
难度: 中等查看答案及解析
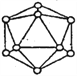


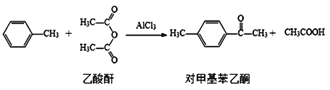

 化合物b中进行sp3杂化的原子有__________个。
化合物b中进行sp3杂化的原子有__________个。
