-
据报道,
Ho可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
A. 32 B. 67 C. 99 D. 166
难度: 简单查看答案及解析
-
在元素周期表中,金属元素与非金属元素分界线附近,能找到( )
A. 制半导体材料的元素
B. 制农药的元素
C. 制催化剂的元素
D. 制耐高温合金的元素
难度: 中等查看答案及解析
-
某一反应物的浓度是2.0mol•L﹣1,经过2min后,它的浓度变成了1.56mol•L﹣1,则在这2min内它的平均反应速率为( )
A.0.22 mol•(L•min)﹣1 B.0.1 mol•(L•min)﹣1
C.0.04 mol•(L•min)﹣1 D.0.08 mol•(L•min)﹣1
难度: 中等查看答案及解析
-
下列措施肯定能使反应速率增大的是( )
A.增大反应物的量 B.增大压强
C.适当升高温度 D.降低反应物浓度
难度: 中等查看答案及解析
-
下列物质中既含有离子键又含有共价键的是( )
A.HCl B.KOH C.I2 D.Na2 O
难度: 中等查看答案及解析
-
下列表示乙炔(化学式为C2H2)燃烧热的热化学方程式的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g)△H=a kJ•mol﹣1
B.C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=b kJ•mol﹣1
C.C2H2(g)+
O2(g)═2CO(g)+H2O(g)△H=c kJ•mol﹣1
D.C2H2(g)+
O2(g)═2CO(g)+H2O(g)△H=d kJ•mol﹣1
难度: 中等查看答案及解析
-
某元素原子的最外层上只有2个电子,该元素是( )
A. 一定是IIA元素
B. 一定是金属元素
C. 一定是正二价元素
D. 可能是金属元素,也可能是非金属元素
难度: 中等查看答案及解析
-
下列叙述中错误的是( )
A. 原子半径:Cl>S>O
B. 还原性:Na>Mg>Al
C. 稳定性:HF>HCl>HBr
D. 酸性:HClO4>H2SO4>H3PO4
难度: 简单查看答案及解析
-
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl.以下对铊的单质及其化合物的性质推断不正确的是( )
A. 铊是易导电的银白色金属 B. 能生成+3价离子
C. 氢氧化铊是两性氢氧化物 D. Tl3+的氧化能力比Al3+强
难度: 中等查看答案及解析
-
在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L•s) B.v(B)=0.3 mol/(L•s)
C.v(C)=0.8 mol/(L•s) D.v(D)=1 mol/(L•s)
难度: 中等查看答案及解析
-
元素Y的原子获得3个电子或元素X失去2个电子后,它们的电子层结构与氖原子的相同,X、Y两元素形成的化合物的正确的化学式是( )
A. Y3X2 B. X2Y3 C. X3Y2 D. Y2X3
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.灼热的炭与CO2反应
C.高温煅烧石灰石
D.甲烷在O2中的燃烧反应
难度: 简单查看答案及解析
-
在化学反应中,反应前与反应后相比较,肯定不变的是( )
①元素的种类
②原子的种类
③分子数目
④原子数目
⑤反应前物质的质量总和与反应后物质的质量总和
⑥反应前反应物的总能量与反应后生成物的总能量.
A.①②③④ B.①②⑤⑥ C.①②④⑤ D.②③⑤⑥
难度: 中等查看答案及解析
-
已知反应A+B=C+D的能量变化如图所示,下列关于此反应的说法不正确的是( )
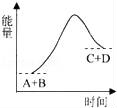
A.是吸热反应
B.只有在加热条件下才能进行
C.生成物的总能量高于反应物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
难度: 中等查看答案及解析
-
在一定条件下,使NO和O2在一密闭容器中进行反应2NO+O2⇌2NO2,下列说法中不正确的是( )
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
D.随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等
难度: 中等查看答案及解析
-
aXn﹣和bYm+为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( )
A. 原子半径X<Y
B. a+n=b﹣m
C. Y最高价氧化物的化学式为YOm
D. X的氢化物的化学式为HnX
难度: 中等查看答案及解析
-
某反应:A⇌B+C 在低温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是( )
A.△H<0、△S<0
B.△H>0、△S<0
C.△H<0、△S>0
D.△H>0、△S>0
难度: 中等查看答案及解析
-
用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.
A.①②④ B.②③④ C.①③④ D.①②③
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)⇌2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
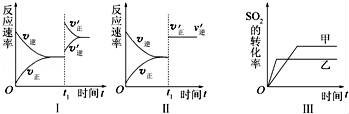
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3mol/L B.Y2为0.4mol/L
C.X2为0.2mol/L D.Z为0.4mol/L
难度: 中等查看答案及解析
-
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应的气态氢化物的稳定性C>D,E是这五种元素中形成简单离子半径最小的元素.则它们的原子序数由小到大的顺序是( )
A. B<A<C<D<E B. A<E<B<C<D
C. E<B<A<C<D D. B<A<E<D<C
难度: 中等查看答案及解析
-
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJ•mol﹣1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJ•mol﹣1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
A.Fe3O4+4CO═3Fe+4CO2/△H=﹣14kJ•mol﹣1
B.Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=﹣22kJ•mol﹣1
C.Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=+14kJ•mol﹣1
D.Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=﹣14kJ•mol﹣1
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为﹣285.8 kJ•mol﹣1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ•mol﹣1
C.已知中和热为﹣57.3 kJ•mol﹣1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ
D.Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H<0
难度: 中等查看答案及解析
-
在密闭容器中进行下列反应:M(g)+N(g)⇌R(g)+2L此反应符合如图象.下列叙述正确的是( )
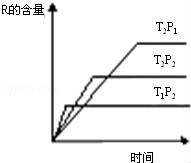
A.正反应吸热,L是气体 B.正反应吸热,L是固体
C.正反应放热,L是液体 D.正反应放热,L是气体
难度: 中等查看答案及解析
-
对于可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO,同时消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若缩小容器体积,则正反应速率减少,逆反应速率增大
D.在恒容容器中,若混合气体密度不再改变,则反应达到平衡状态
难度: 中等查看答案及解析