-
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
元素
T
X
Y
Z
性质
结构
信息
人体内含量最多的元素,且其单质是常见的助燃剂。
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。
单质质软、银白色固体、导电性强。
单质在空气中燃烧发出黄色的火焰。
第三周期元素的简单离子中半径最小
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式________;离子半径比较:Y离子________Z离子(填“>”或“<”)。
(2)写出Z原子的核外电子排布式________。
(3)Z的最高价氧化物对应水化物的电离方程式________。
(4)元素T与氟元素相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
难度: 困难查看答案及解析
-
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。

请回答下列问题:
(1)A的化学式为________,在水中的溶解性________(选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是。
G→J的化学方程式为________。
反应的现象是________。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因________。
难度: 困难查看答案及解析
-
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)请用氧化物的形式表示硼砂的化学式________。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: ________。
(21)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于第________周期,第________族。
(3)能用于比较N与O非金属性相对强弱的事实是________。
A.最高价氧化物对应水化物的酸性 B.H2O(g) 比NH3(g)稳定
C.单质与H2反应的难易程度 D.NO中氮元素显正价,氧元素显负价
(4)写出生成物中含极性键的非极性分子的电子式为 。
(5)与硼同主族且相邻周期的元素,其最高价氧化物与NaOH溶液反应的离子方程式 为:________。
难度: 困难查看答案及解析
-
高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应配平后的离子方程式____________________。
(2)不同条件下高锰酸钾可发生不同如下反应:
MnO4-+5e+8H+→Mn2++4H2O MnO4-+3e+2H2O→MnO2+4OH- MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与________有关。
(3)高锰酸钾可代替二氧化锰用来制取Cl2,反应中氧化剂和还原剂物质的量之比为_____________。
(4)高锰酸钾溶液与硫化亚铁在酸性条件下发生如下反应:
10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为________。
难度: 困难查看答案及解析
-
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
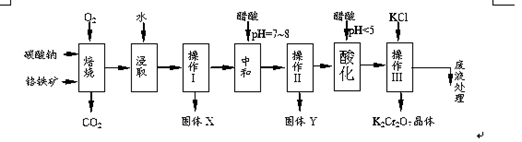
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl → K2Cr2O7↓+2NaCl。
物质
溶解度/(g/100g水)
0°C
40°C
80°C
KCl
28
40.1
51.3
NaCl
35.7
36.4
38
K2Cr2O7
4.7
26.3
73
Na2Cr2O7
163
215
376
该反应在溶液中能发生的理由是_______________。
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_________(用含m、n的代数式表示)。
难度: 极难查看答案及解析
-
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O→SO
+ 2Fe2+ + 4H+
Cr2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式:________。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为,制得98%的硫酸质量为________ t ,SO2全部转化为H2SO4时放出的热量是________ kJ。
难度: 困难查看答案及解析
-
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质
Al
Al2O3
Fe
Fe2O3
熔点/℃
660
2054
1535
1462
沸点/℃
2467
2980
2750
--
Ⅰ.某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。
你认为他的解释是否合理?答:__________(填“合理”或“不合理”)
(1)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,
反应的离子方程式为________。
(2)实验室溶解该熔融物,下列试剂中最好的是________ (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
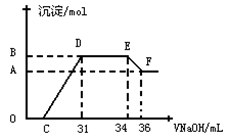
(3)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________
(4)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为__________
(5)上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(6)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为_______mL。
难度: 极难查看答案及解析
-
在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2
是_______mol;生成的NaNO3是_______mol 。
(2)NO和NO2的混合气体的组成可表示为NOX ,该混合气体通入NaOH溶液被
完全吸收时,x的值可以为________(填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(3)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
请写出纯碱溶液吸收NO2的化学方程式:____________________
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为:________;该Na2CO3溶液的物质的量浓度为________mol/L(用含a、b的代数式表示)。
(5)若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为________。
难度: 困难查看答案及解析