-
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强难度: 中等查看答案及解析
-
将过量的CO2分别通入①CaCl2溶液,②Na2SiO3溶液,③Ca(ClO)2溶液,④饱和Na2CO3溶液,最终有沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③难度: 中等查看答案及解析
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是( )
A.XYZ3
B.X2YZ4
C.X3YZ4
D.X4Y2Z7难度: 中等查看答案及解析
-
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.X+2
B.X+4
C.X+8
D.X+18难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都有从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子难度: 中等查看答案及解析
-
某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出,该溶液可能大量存在的一组离子是( )
A.K+、H+、NO3-、Na+
B.H+、Br-、SO42-、Na+
C.SO42-、Br-、OH-、Fe3+
D.H+、Br-、SO32-、K+难度: 中等查看答案及解析
-
一些科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第七周期,第ⅣA族,下列说法正确的是( )
A.第七周期有50种元素
B.该原子的质量数为184
C.该元素的相对原子质量为292
D.该原子核外有114个电子难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
下列叙述错误的是( )元素代号 L M X R T 原子半径/nm 0.160 0.143 0.102 0.089 0.074 主要化合价 +2 +3 +6,-2 +2 -2
A.R的氧化物对应的水化物可能具有两性
B.X单质在氧气中燃烧不可能生成XO3
C.离子半径大小:r(M3+)<r(T2-)
D.L2+和X2-的电子层结构相同难度: 中等查看答案及解析
-
下列说法都正确的是
①使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
②四川灾区重建使用了大量钢材,钢材是合金
③积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物( )
A.①②③④
B.①②④⑥
C.①②⑤⑥
D.②③④⑤⑥难度: 中等查看答案及解析
-
下列实验能达到实验目的且符合安全要求的是( )
A.
制备氢氧化亚铁并观察其颜色
B.
收集氧气
C.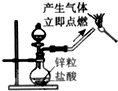
制备并检验氢气的可燃性
D.
浓硫酸稀释难度: 中等查看答案及解析
-
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层上只有一个电子,下列说法正确的是( )
A.X可能是第二周期的非金属元素
B.X可能是第三周期的金属元素
C.Y可能与X同主族
D.Y一定是金属元素难度: 中等查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如图所示.已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍.则A、B、C分别是( )
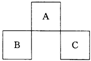
A.C、A.l、P
B.N、Si、S
C.0、P、Cl
D.F、S、Ar难度: 中等查看答案及解析
-
右图为周期表中短周期的一部分,若a原子的最外层上有5个电子,则下列说法中不正确的是( )
A.d单质可跟b的氢化物的水溶液反应
B.原子半径a>b>c
C.b的氢化物比a的氢化物稳定
D.a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性强难度: 中等查看答案及解析
-
室温下,下列物质不与晶体硅反应的是( )
A.F2
B.HF
C.KOH溶液
D.Cl2难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.向澄清的石灰水中通入过量的CO2 CO2+OH-=HCO3-
B.向FeBr2溶液中通入少量Cl2 2Br-+Cl2=Br2+2Cl-
C.向Ca(ClO)2溶液中通入过量CO2 Ca2++2ClO-+2H2O+CO2═CaCO3↓+2HClO
D.向氨水中通入少量SO2 NH3•H2O+SO2═NH4++HSO3-难度: 中等查看答案及解析
-
用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况)( )
A.O2和H2的混合气体
B.1.12LH2
C.大于1.12LH2
D.小于1.12LH2难度: 中等查看答案及解析
-
镭(Ra)位于周期表的第七周期ⅡA族.下列关于镭的性质的描述不正确的是( )
A.在化合物中呈+2价
B.单质能与水反应产生氢气
C.氢氧化物呈两性
D.碳酸盐难溶于水难度: 中等查看答案及解析
-
把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如右图,则合金中镁和铝的质量比是( )
A.1:1
B.8:9
C.4:3
D.4:9难度: 中等查看答案及解析
-
研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解.过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成.下列所得结论不正确的是( )
A.铜与浓硫酸反应所得白色固体是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO4
C.白色固体中夹杂的少量黑色物质可能是CuO
D.白色固体中夹杂的少量黑色物质中含元素Cu、S难度: 中等查看答案及解析
