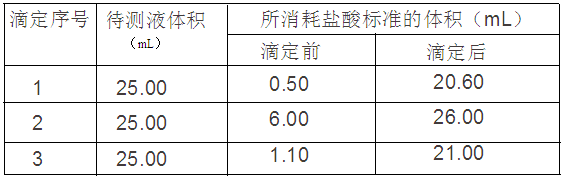
-
下列各组热化学方程式中,化学反应的前者大于后者的是( )
①C(s)+O2(g)=CO2(g)△H1;C(s)+1/2O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H3;S(g)+O2Cg)=SO2Cg)△H4
③H2(g)+1/2O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(1)△H6
④CaCO3(s)=CaO(s)+CO2(g)△H7;CaO(s)+H2O(l)=Ca(OH)2(s)△H8
A.②③④ B.④ C.① D.①②③
难度: 中等查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
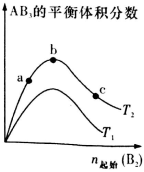
A.正反应一定是放热反应
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.b点时,平衡体系中A、B原子数之比接近3:1
难度: 困难查看答案及解析
-
对可逆反应 4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
B.若单位时间内圭成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C.达到化学平衡时,4v正(O2)=5v逆(NO)
D. 化学反应速率关系是:2 v正(NH3)=3 v正(H2O)
难度: 中等查看答案及解析
-
把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均匀加水稀释到50 mL。此时X和盐酸进行反应,其中反应速率最大的是( )
A.40mL1.5mol/L的X溶液
B.20mL2mol/L的X溶液
C.10mL4mol/L的X溶液
D.10mL2mol/L的X溶液
难度: 简单查看答案及解析
-
对于平衡体系:aA(g)+bB(g)
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则 a+b>c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则投入A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入6 mol B,达到平衡时 气体总物质的量为(M+b)mol,则a+b>c+d
D. a+b=c+d,则当容器温度上升时,平衡向左移动,容器中气体的压强不变
难度: 困难查看答案及解析
-
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2 (g) +3H2 (g)
2NH3 (g)△H = - 92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:

下列叙述正确的是( )
A.放出热量关系:a<b<92.4 B.放出热量关系:b<a< 92.4
C.平衡时氨气的体积分数:①>③ D.N2的转化率:②>①>③
难度: 困难查看答案及解析
-
25℃时,相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4;④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④ C.③>②>①>④ D.④>①>②>③
难度: 中等查看答案及解析
-
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
A.加入适量的氯化按晶体后,两溶液的pH均减小
B.温度降低10℃,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.分别用盐酸中和,消耗的盐酸体积相同
难度: 中等查看答案及解析
-
下列实验操作或所记录的数据合理的是( )
A. NaOH溶液可保存在玻璃塞的试剂瓶中
B. 一学生用pH试纸测得某氯水的pH为2
C. 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中
D. 配制硫酸亚铁溶液,是将晶体溶于蒸馏水再加入一定量的铁粉
难度: 简单查看答案及解析
-
下列除杂方法不正确的是( )
A.除去NH4C1溶液中的FeCl3,可向溶液中加入氨水调节pH
B.除去金属离子Cu2+、Hg2+,可向溶液中加入Na2S、H2S等沉淀剂
C.除去某溶液中的SO42-,可向溶液中加入镁盐
D. 除去ZnCl2溶液中的Fe3+,可向溶液中加入Zn(OH)2
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙呈红色的溶液中:K+、AlO2-、NO3-、CO32-
B.c(ClO-)=1.0mol/L的溶液:Na+、SO32-、S2-、Cl-
C.水电离出来的c(H+)=l×l0-12mol/L的溶液:K+、NH4+、SO42-、Fe3+
D.
的溶液:Na+、AlO2-、CO32-、NO3-
难度: 困难查看答案及解析
-
用标准盐酸溶液滴定待测浓度的碱溶液时,下列操作中会引起碱溶液浓度的测定值偏大的是( )
A.锥形瓶里溶液在滴定过程中溅出
B.锥形瓶用蒸馏水冲洗后未用待测液润洗
C.指示剂变色15 s后又恢复为原来的颜色便停止滴定
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失
难度: 中等查看答案及解析
-
25℃时,在10 mL浓度均为0.1 mol/L NaOH和NH3 •H2O的混合溶液中,滴加0.1 mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+) =c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+)+c(H+)+ c(Na+)= c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
D.加入20 mL盐酸时: c(Cl-)= c(NH4+)+c(Na+)
难度: 困难查看答案及解析
-
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A.图中a点对应的是AgBr的不饱和溶液
B.在t °C时,AgBr的Ksp为 4.9×10-13
C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D.在t °C时,AgCl(s)+Br-(aq)
AgBr(s)+C1- (aq)的平衡常数K≈816
难度: 困难查看答案及解析
-
已知常温下,0.1 mol • L-1的HA溶液中 c(OH-)/c(H+) = 1×10-8,下列叙述中正确的是( )
A.0.01 mol • L-1HA的溶液中 c(H+)=l×l0-4mol • L-1
B.pH=3的HA溶液与pH = ll的NaOH溶液等体积混合后所得溶液中 :c(Na+)=c(A-)>c(OH-)=c(H+)
C.浓度均为0.1 mol • L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(H+)- c(OH-)>c(A-)-c(HA)
D.pH=3的HA溶液与pH = 11的NaOH溶液混合后所得溶液显碱性,则 c(Na+)> c(A-)>c(OH-)><c(H+)
难度: 困难查看答案及解析
-
R知某温度电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0• 1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是( )

A. a点表示溶液中c(CH3COO-)一定为10-3 mol/L
B. b点表示的溶液中c(Na+)< c(CH3COO-)
C. c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中
 大于K
大于K难度: 困难查看答案及解析

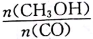 增大的措施有____________。
增大的措施有____________。