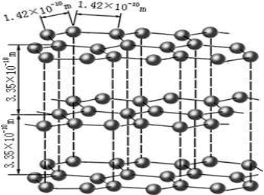
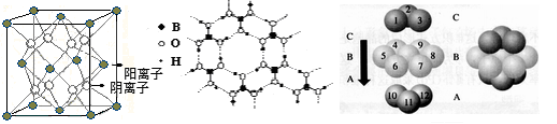
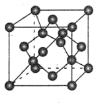
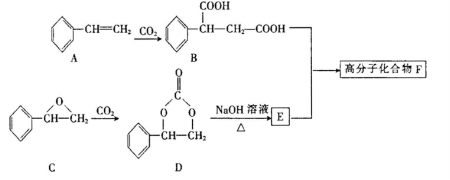
-
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
A.该未知物X为Na2SO4
B.该反应的氧化剂是KIO3
C.该反应中,发生氧化反应的过程是KIO3→I2
D.由反应可知还原性强弱顺序为:Na2SO3>I2
难度: 中等查看答案及解析
-
下列化学药品中的试剂瓶上所贴化学危险品标志有错误的是
A B C D
物质 Na2O2 三硝基甲苯 浓H2SO4 CCl4
危险警告标识




难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数。下列叙述不正确的是
A.标准状况下,2.24 L Cl2完全溶于足量的水中,转移电子的数目为0.1NA
B.常温常压下,11.0g C3H8中含有共价键的数目为2.5NA
C.常温常压下,1 L 0.1 mol·L-1 NH4NO3溶液中NO3-的数目为0.1NA
D.30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA
难度: 中等查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
操作 现象 结论
A 先滴加BaCl2溶液,再加稀HNO3 生成白色沉淀,
且沉淀不溶解。 原溶液中有SO42-
B 滴加氯水和CCl4,振荡、静置 下层溶液显紫红色 原溶液中有I―
C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+、无K+
D 滴加NaOH溶液加热,将红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是:
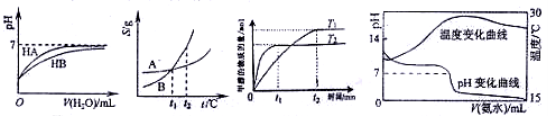
图1 图2 图3 图4
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液PH随加水量的变化,则NaA溶液的PH小于同浓度的NaB溶液的PH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数 B﹥A。
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应。
D.图4表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液PH和温度随加入氨水体积变化曲线
难度: 中等查看答案及解析
-
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是

A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中碳碳双键、酚羟基两种基团至少存在一种。
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb

下列有关说法正确的是:(Pb的相对原子质量:207)
A.正极反应式:Ca+2Cl- - 2e- = CaCl2
B.常温时,在正负极间接上电流表或检流计,指针不偏转。
C.放电过程中,Li+向负极移动
D.每转移0.1mol电子,理论上生成20.7gPb
难度: 中等查看答案及解析