-
已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1mol NH4CuSO3完全反应转移0.5mol电子
难度: 中等查看答案及解析
-
下列说法不正确的是
A.天津港爆炸案中对剧毒的氰化钠(NaCN)喷洒双氧水消毒,利用了双氧水的氧化性
B.碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应
C.刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐
D.石油原油的脱水,有色玻璃、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 3.4g H2O2中含有的共用电子对数为0.1NA
B. 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA
C. 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
D. 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA
难度: 中等查看答案及解析
-
分子中苯环上的一个氢原子被-C4H9原子团取代形成的有机物共有( )
A. 9种 B. 10种 C. 12种 D. 15种
难度: 中等查看答案及解析
-
今有两种正盐的稀溶液,分别是a mol·L-1 NaX溶液和b mol·L-1 NaY溶液,下列说法不正确的是
A.若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol·L-1 ,则可推出a+b=0.2 mol·L-1 (忽略两溶液混合时溶液体积的改变)
难度: 困难查看答案及解析
-
已知X、Y、Z、W都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,W的族序数比X的族序数大1,则下列说法错误的是
A. Y和Z可以组成一种Y和Z的质量比为7:20的共价化合物
B. X、Y、Z可以组成一种盐,其中X、Y、Z元素原子个数比为4:2:3
C. Y和W组成的化合物与X和Z组成的化合物反应可生成2种碱性物质
D. 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种
难度: 困难查看答案及解析
-
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述中正确的是。
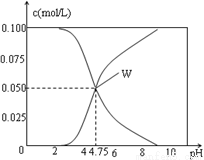
A. 由题给图示可求出25℃时醋酸 的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. W点所表示的溶液中c(Na+) + c(H+)=c(CH3COOH)+c(OH-)
C. pH=3.5的溶液中: c(Na+) + c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L
D. 向W点所表示的1L溶液中通入0.05molHCl气体(溶液的体积变化可忽略):c(H+)=c(CH3COO-)+c(OH-)
难度: 困难查看答案及解析


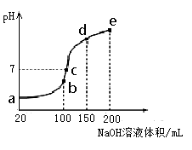
 (3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,