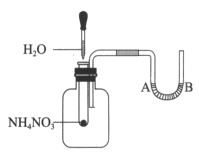
-
下列物质不属于合金的是
A.生铁 B.水银 C.青铜 D.硬铝
难度: 简单查看答案及解析
-
下列物质中,可用于治疗胃酸过多的是
A. 氢氧化铝 B.氯化钠 C.氢氧化钠 D.硫酸钠
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是
A.泥浆 B.CuSO4溶液 C.酒精溶液 D.Fe(OH)3胶体
难度: 简单查看答案及解析
-
氧气的摩尔质量是
A.32 B.32 g C.32 mol D.32 g·mol-1
难度: 简单查看答案及解析
-
下列金属在冷、浓的硝酸或硫酸中,能形成致密氧化膜的是
A.Mg B.Fe C.Cu D.Na
难度: 简单查看答案及解析
-
实验室中配制250 mL 0.10 mol·L-1NaOH溶液时,必须使用到的玻璃仪器是
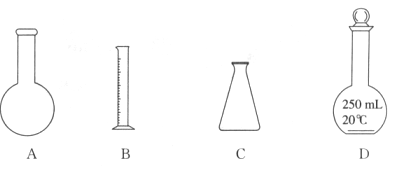
难度: 中等查看答案及解析
-
下列物质常用作工业生产制冷剂的是
A.液氨 B.液氧 C.液氯 D.液氢
难度: 简单查看答案及解析
-
下列物质不能使品红溶液褪色的是
A.氯气 B.过氧化钠 C.次氯酸钠 D.氢氧化钠
难度: 中等查看答案及解析
-
下列物质属于电解质且能导电的是
A.金属铜 B.碳酸钠晶体
C.硝酸钠溶液 D.熔融氯化钠
难度: 简单查看答案及解析
-
下列各组物质不能用焰色反应鉴别的是
A.NaCl和Na2CO3 B.Na2CO3和BaCO3
C.CuCl2和CaCl2 D.Na2O2和K2O2
难度: 简单查看答案及解析
-
下列有关萃取的说法不正确的是
A.萃取在香料、药物的提取中应用广泛
B.用乙醇作萃取剂,萃取碘水中的碘单质
C.用四氯化碳萃取碘水时,下层溶液呈紫色
D.萃取后的混合物进行分离时,要使用分液漏斗
难度: 中等查看答案及解析
-
下列有关酸雨的说法不正确的是
A.在酸雨形成过程中没有发生氧化还原反应
B.二氧化硫、二氧化氮是形成酸雨的主要因素
C.煤和石油的燃烧、汽车尾气等是酸雨污染物的主要来源
D.酸雨的危害有破坏农作物,使土壤、湖泊酸化以及加速建筑物、桥梁的腐蚀等
难度: 中等查看答案及解析
-
下图是喷泉实验装置图,下列说法正确的是
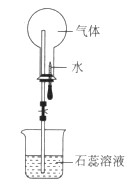
A.烧瓶中的溶液呈红色,则原气体一定是SO2
B.形成喷泉的原因是烧瓶内压强小于外界大气压
C.烧瓶中的溶液呈蓝色,则原气体一定属于碱类物质
D.若将石蕊改成氢氧化钠,则CO、CO2均能形成喷泉
难度: 中等查看答案及解析
-
下列存放物质的方法不正确的是
A.用棕色细口试剂瓶存放氯水
B.漂白粉需在密闭容器中保存
C.HF溶液保存在玻璃试剂瓶中
D.NaOH溶液盛装在带橡皮塞的试剂瓶中
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.氯化铝溶液与过量的氢氧化钠溶液反应:Al3++3OH-=Al(OH)3↓
C.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.碳酸氢钠溶液与稀盐酸反应:2H++CO32-=CO2↑+H2O
难度: 中等查看答案及解析
-
已知阿伏加德罗常数约为6.02×1023,下列叙述正确的是
A.1.8g的NH4+,中含有的电子数为0.1×6.02×1023
B.常温常压下,11.2L氯气所含的原子数为6.02×1023
C.常温常压下,18g H2O含有的原子数为3×6.02×1023
D.5.6g金属铁变为离子时失去的电子数为0.2×6.02×1023
难度: 困难查看答案及解析
-
用化学方法区别NaCl、MgCl2、AlCl3、CuCl2、FeCl3和NH4Cl六种溶液(必要时可加热),下列试剂中可选用的是
A.KSCN溶液 B.AgNO3溶液
C.BaCl2溶液 D.NaOH溶液
难度: 中等查看答案及解析
-
下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
①Al ②Al2O3 ③Ca(OH)2 ④Al(OH)3 ⑤Na2CO3 ⑥NaHCO3
A. ①②③⑤ B.①②④⑥ C.①②⑤⑥ D.②③④⑥
难度: 中等查看答案及解析
-
向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是
操作
现象
结论
A
①滴加稀HNO3
②滴加BaCl2溶液
无明显现象
白色沉淀
原溶液一定含
B
滴加稀盐酸
有大量气泡产生
原溶液一定含
C
①滴加稀HCl
②滴加AgNO3溶液
无明显现象
白色沉淀
原溶液一定含Cl-
D
①滴加KCSN溶液
②滴加氯水
无明显现象
溶液呈红色
原溶液一定含Fe2+
难度: 困难查看答案及解析
-
用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应;
②铜与浓硝酸反应;
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述不正确的是
A.三种途径所消耗铜的质量相等
B.三种途径所消耗硝酸的物质的量是①>②>③
C.途径③的制备方法最符合“绿色化学”理念
D.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3:2
难度: 中等查看答案及解析