-
(14分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲 + 乙 丙 + 丁 + 水。
丙 + 丁 + 水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为________。
②火箭常用NO2的二聚体N2O4作氧化剂,肼(N2H4)作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g) N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼(N2H4)在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:________
___________________________________________________。
③肼又称联氨,广泛用于火箭推进剂、有机合成及燃料电池。肼燃料电池原理如右图所示,右边电极为________(填“正极”、“负极”),左边电极上发生的电极反应式为。

(2)若丙为SO2。
①把乙滴入硫酸铜晶体中,观察到的现象是________。
②SO2气体有毒,多余的SO2气体常用足量的NaOH溶液吸收,写出吸收液中离子浓度由大到小的顺序:。
③在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关反应:
SO2-2e-+2H2O = SO42-+4H+反应的说法错误的是 。
A.该反应为氧化反应
B.上述反应中若转移电子物质的量为0.05mol,则生成溶液的PH值为1
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用
-
(14分)运用化学反应原理研究NH3的性质具有重要意义。
(1)科学家一直致力于“人工固氮”的新方法研究。据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质。在使用催化剂b和不使用催化剂a时,该反应过程和能量的变化关系如图所示。
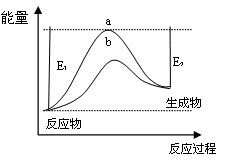
①写出该反应的化学方程式。
②a和b相比,二者的平衡常数关系是Ka________Kb(填“>”、“=”或“<”)
③升高温度,平衡时NH3的含量________(填“增大”、“不变”或“减小”)
(2)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g) + 3H2(g)  2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2)________v逆(N2)(填 “>” 、“=” 或 “<”)
2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2)________v逆(N2)(填 “>” 、“=” 或 “<”)
(3)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度mol.L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
①则2 ~4min内,v(O2) = ________ 。
②在第8min时改变条件,你认为改变的条件可能是________。
(4)常温下,向0.001 mol·L-1的AlCl3 溶液中通入NH3直至过量,现象,当PH = ________时,开始生成沉淀(已知:Ksp[Al(OH)3]= 1.0×10-33)。
-
(15分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设 ①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是________。
(2)设计方案 如下图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

(3)查阅资料氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)
饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:________。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为;
________ 。
(5)数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:________
。
(6)实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:。
-
【化学—选修2:化学与技术】(15分)
石膏转化为硫酸钾和CaCl2的工艺流程如下:
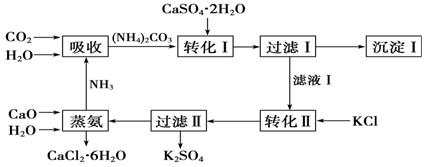
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是 (用化学方程式表示)。
(2)转化Ⅰ中发生反应的离子方程式为 。过滤Ⅰ得到的滤液是 ,检验滤液中含有CO的方法是_________________________________。
(3)转化Ⅱ中发生反应的化学方程式为 ,转化Ⅱ中可获得K2SO4的原因是__________________________________________________。
(4)上述工艺流程中体现绿色化学理念的是______________________________________。
(5)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29 ℃熔化) b.能制冷
c.无毒 d.能导电
-
【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式________
(2)B基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了________
(4)G位于________族________区,价电子排布式为
(5)DE3 中心原子的杂化方式为________,用价层电子对互斥理论推测其空间构型为________
(6)检验F元素的方法是________ ,请用原子结构的知识解释产生此现象的原因是________
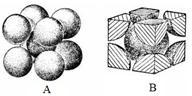
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为________ cm
-
【化学—选修5:有机化学基础】(15分)
A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
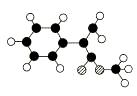
Ⅰ.根据分子结构模型写出A的分子式________,A的核磁共振氢谱有_______个吸收峰。
Ⅱ.以 为主要原料合成A的路线如下:
为主要原料合成A的路线如下:
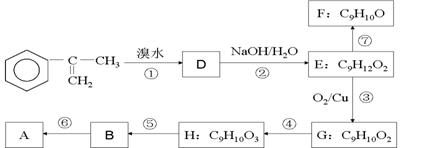
(1)下列反应的反应类型:④________ ⑥ ________ ;
(2)H的结构简式为___________________,B中官能团的名称为 ;
(3)写出反应②的化学方程式(注明必要的条件)________
(4)已知烯醇式不稳定,会转化为醛:R—CH=CH—OH → R—CH2—CHO。反应⑦生成的有机物有两种可能,它们的结构简式分别为、,要把它们区别开来,可使用的试剂是 。
是一种常用的退热、镇痛药物,临床常用于预防心血管疾病。阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用。则下列对此化合物说法不正确的是 ( )
H2S + 2OH-







