-
25℃时,在等体积的 ① pH=0的H2SO4溶液 ②0.05mol·L-1的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A. 1∶10∶1010∶109 B. 1∶5∶5×109∶5×108
C. 1∶20∶1010∶109 D. 1∶10∶104∶109
难度: 困难查看答案及解析
-
准确移取20.00mL某待测HCl溶液于维形瓶中,用0.1000mol/LNaOH溶液滴定。下列说法正确的是
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH 由小变大
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色,且半分钟不变色时,停止滴定
D. 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 简单查看答案及解析
-
25 ℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是( )
A.对于该溶液一定存在:pH≥7
B.在c(OH-)>c(H+)的溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
C.若溶液中c(A-)=c(Na+),则溶液一定呈中性
D.若溶质为NaA,则溶液中一定存在: c(Na+)>c(A-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
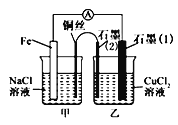
用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3 CuCl2 Cu(NO3)2
B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3
D.HCl HNO3 K2SO4
难度: 中等查看答案及解析
-
下列事实一定能证明HNO2是弱电解质的是
①常温下 NaNO:溶液的pH大于7
②HNO2不稳定,受热易分解
③HNO2和NaCl不能发生反应
④常温下0.1 mol·L一1HNO2溶液的pH=2.1
⑤常温下pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合,pH小于7
⑥常温下pH=2的HNO2溶液稀释至100倍,pH约为3.1
A. ①④⑥ B. ①②④⑤⑥ C. ①④⑤⑥ D. 全部
难度: 中等查看答案及解析
-
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)
Ca(OH)2(aq)
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
A. n(Ca2+)增大 B. c(Ca2+)不变 C. n(OH-)增大 D. c(OH-)减小
难度: 中等查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是
①
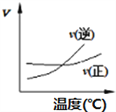 ②
②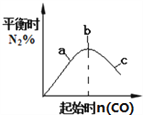 ③
③ ④
④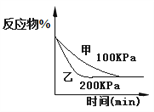
A. A2(g)+ 3B2(g)
2AB3(g),如图①说明此反应的正反应是吸热反应
B. 4CO(g) +2NO2(g)
N2(g)+4CO2(g) ,如图② 说明NO2 的转化率b>a>c
C. N2(g)+ 3H2(g)
2NH3(g),如图③说明t秒时合成氨反应达到平衡
D. 2A(g)+2B(g)
3C(g)+D(? ),如图④说明生成物D一定是气体
难度: 中等查看答案及解析
-
已知: C(s) +2H2O(g)==CO(g)+H2(g) △H=a kJ·mol-1
2C(s) +O2(g)==2CO(g) △H=-220kJ·mol-1
H-H、O==O和O—H键能分别为436kJ·mol-1、496kJ·mol-1和462kJ·mol-1,则a为
A. 332 B. -118 C. +350 D. +130
难度: 简单查看答案及解析
-
一定温度下反应:A2(g)+3 B2(g)
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
难度: 中等查看答案及解析
-
25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。
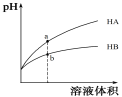
下列说法正确的是
A.同浓度的NaA与NaB溶液中,c(A-) 小于c(B-)
B.a点溶液的导电性大于b点溶液
C.a点的c(HA)大于b点的c(HB)
D.HA 的酸性强于HB
难度: 中等查看答案及解析
-
室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,有关该溶液的判断正确的是
A. c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
B. Ka1(H2CO3)•Ka2(H2CO3)<KW
C. c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-)
D. 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
难度: 中等查看答案及解析
-
在体积都为1L,pH都等于2的盐酸和醋酸溶液中,各投入0.65g锌粒,则下图所示比较符合客观事实的( )
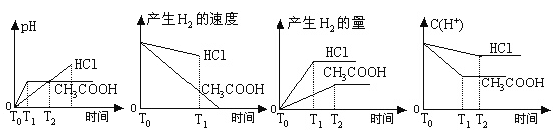
A. B. C. D.
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-11。某溶液中含有Cl-,Br-,CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-、
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
难度: 困难查看答案及解析
-
25℃时,下 列有关溶液中微粒的物质的量浓度关系正确的是
A. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1mol/LNa2CO3溶液与0.1mol /LNaHCO3溶液等体积混合:2c(Na+)= 3c(CO32-)十3c(HCO3-)+3c(H2CO3)
C. 0.1mol/LNH4Cl溶液与0.1mol/L 氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D. 0.1mol/LNa2C2O4溶液与0.1mol/L HCl 溶液等体积混合(H2C2O4 为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
难度: 困难查看答案及解析
-
常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
难度: 中等查看答案及解析
-
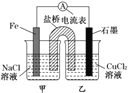
液流电池是一种新的蓄电池,是利用正负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是

A.充电时阳极的电极反应式:Zn-2e-
Zn2+
B.充电时电极a为外接电源的负极
C.放电时Br-向右侧电极移动
D.放电时左右两侧电解质储罐中的离子总浓度均增大
难度: 中等查看答案及解析
-
下列5种混合溶液,分别由0.1mol/L的两种溶液等体积混合而成:①CH3COONa 与NaHSO4 ②CH3COONa 与NaOH ③CH3COONa 与NaCl ④CH3COONa 与NaHCO3 ⑤CH3COONa 与NaHSO3。下列各项排序正确的是
A. pH:②>④>⑤>③>① B. c(CH3COOH):①>③>⑤>④>②
C. (CH3COO-):②>③>④>⑤>① D. c(CH3COOH)/c(CH3COO-):①>⑤>③>④>②
难度: 困难查看答案及解析
-
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 原混合溶液中c(Na+)=0.2 mol·L-1
B. 电解后溶液中c(H+)=0.2 mol·L-1
C. 上述电解过程中共转移0.4 mol电子
D. 电解后得到的Cu的物质的量为0.1 mol
难度: 中等查看答案及解析