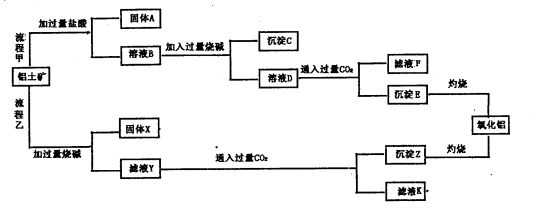
-
亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与氧气结合的能力。误食亚硝酸钠中毒,可服维生素C缓解,则亚硝酸钠和维生素C分别表现出的性质是 ( )
A.氧化性、还原性 B.还原性、氧化性
C.氧化性、酸性 D.还原性、碱性
难度: 中等查看答案及解析
-
下列有关说法正确的是 ( )
A.1H、D+、T2互为同位素
B. H2O、,CH3COOH、NH4HCO3都是电解质
C.饱和氯化铁溶液、淀粉溶液、牛奶都属于胶体
D.水晶、水泥、陶瓷都是硅酸盐产品
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.1 molCl2参加反应转移电子数一定为2NA
B.7.8gNa2O2中含有的阴离子数为0.1NA
C.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
D.1 mol FeCl3跟水完反应转化为氢氧化铁胶体,其中胶体粒子的数目为NA
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是 ( )
A.加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-
B.含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C.C(H+)/c(OH-)=l×10-10的溶液中:.NH4+、K+、Ca2+、Cl-
D.水电离的c(H+)=l×l0-12mol·L-1的溶液中:Na+、K+、HCO3-、Cl-
难度: 中等查看答案及解析
-
下列离子方程式的书写中,正确的是 ( )
A.碳酸氢钙溶液中加入足量烧碱溶液:Ca(HCO3)2+2OH-=CaCO3↓+CO32-+2H2O
B.向溴水中通入SO2:Br2+2H2O+SO2=4H++SO42-+2Br-
C.向氨水中通过量CO2:2NH3+H2O+CO2=2NH4++CO32-+H2O
D.向次氯酸钙溶液中通过少量的SO2:Ca++2ClO-+SO2=CaSO3↓+2HClO
难度: 中等查看答案及解析
-
下列各图所示装置的气密性检查中,漏气的是 ( )
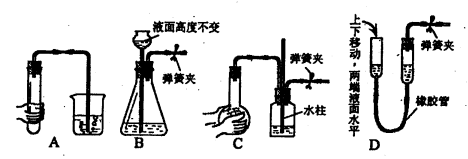
难度: 中等查看答案及解析
-
下列事实的解释错误的是 ( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜不溶于水,也不溶于稀硫酸
D.常温下,浓硝酸可以用铝容器贮存,说明铝与浓硝酸不反应
难度: 中等查看答案及解析
-
在氧化还原反应的过程中,氧化反应和还愿反应同时发生,有关SO2+2H2O→SO42-+4H++2e-反应的说法错误的是 ( )
A.该反应为氧化反应
B.上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用
难度: 中等查看答案及解析
-
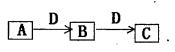
下列各组物质按右图所示转化关系每一步都能一步实现的是( )
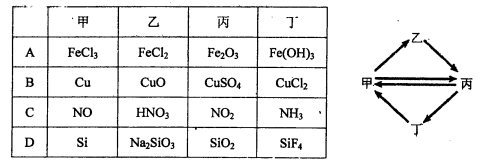
难度: 中等查看答案及解析
-
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A.用50mL 12 mol·L-1的氯化氢水溶液与足量二氧化锰共热制取氯气
B.将1g铝片投入20mL 18.4 mol·L-1的硫酸中
C.向100mL 3 mol·L-1的硝酸中加入5.6g铁
D.常温常压下,0.1mol氯气通入1L水中反应
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,在周期表中位置如图所示。
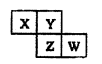
Y原子的最外层电子数是电子层数的3倍。下列说法中不正确的是 ( )
A.Y、Z的气态氢化物,前者更稳定
B.z、w的最高价氧化物对应水化物的酸性,前者强
C.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键
D.Y、W的单质,均可通过电解的方法获得
难度: 中等查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期主族元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
化学小组测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
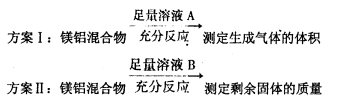
下列有关判断中不正确的是
A.溶液A选用NaOH溶液
B.若溶液B选用浓硝酸,则测得镁的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
难度: 中等查看答案及解析
-
某溶液中可能存在Na+、Mg2+、Al3+、Br一、I一、CO32-、SO32-等七种离子中的几种。现取该溶液进行实验,得到如下实验现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断,该溶液中肯定不存在的离子是( )
A.Al3+、Mg2+、SO32-、I— B.Mg2+、Na+、CO32一、I—
C.Al3+、Na+、SO32一、I— D.Al3+、CO32一、Br一、SO32一
难度: 中等查看答案及解析
-
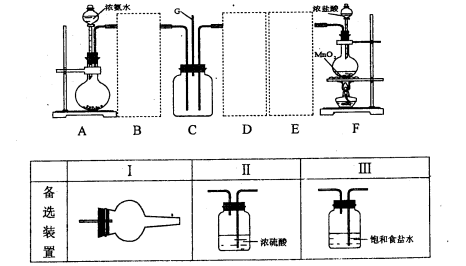
下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )
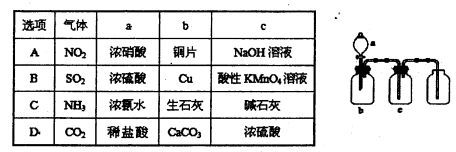
难度: 中等查看答案及解析
-
磁性氧化铁与稀HNO3发生反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O。下列判断合理的是 ( )
A.Fe(NO3)x中的x为2
B.反应中每生成0.2mol还原产物,就有0.6mol电子转移
C.稀HNO3在反应中只作氧化剂
D.磁性氧化铁中的所有铁元素全部被氧化
难度: 中等查看答案及解析