-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为
A. 9.0 L B. 13.5L C. 15.7 L D. 16.8 L
难度: 中等查看答案及解析
-
中国首条“生态马路”在上海复兴路隧道建成,它运用“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( )
A. 使用光催化剂不改变反应速率 B. 使用光催化剂能增大NO的转化率
C. 升高温度能加快反应速率 D. 改变压强对反应速率无影响
难度: 简单查看答案及解析
-
在下列给定条件下的溶液中,一定能大量共存的离子组是( )
A. 无色溶液:Ca2+、H+、Cl-、HSO3-
B. 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C. c(H+)=c(OH-)溶液:K+、Fe3+、SO42-、NO3-
D. 加水稀释时c(H+)/c(OH-)值明显增大的溶液中:SO32-、Cl-、NO3-、Na+
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是
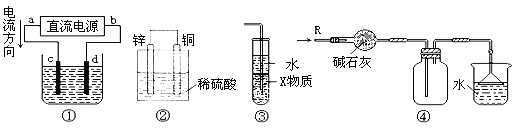
A. 若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
难度: 中等查看答案及解析
-
化学平衡常数K、弱电解质的电离平衡常数Ka或Kb及溶度积常数Ksp是高中化学中常见的几种常数。它们都能反映相应的可逆变化进行的程度,下列关于以上常数的说法正确的是( )
A. 若改变条件使可逆反应平衡右移,则达到新的平衡时的平衡常数K一定增大
B. 一定温度下,在a mol·L-1的饱和石灰水中加入适量的b mol·L-1 CaCl2溶液(b>a),则一定有Ca(OH)2析出
C. 相同温度时,CH3COOH的电离平衡常数Ka与NH3·H2O的电离平衡常数Kb相等,所以CH3COONH4的水溶液显中性
D. 升高温度,以上常数均增大
难度: 中等查看答案及解析
-
如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是( )
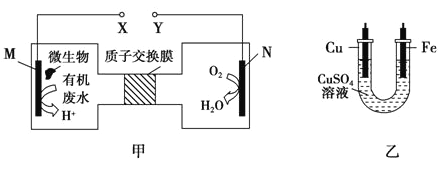
A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
难度: 简单查看答案及解析
-
下列关于物质的说法正确的有( )项
①金刚石、白磷都属于单质
②0.1 mol·L-1 Na2CO3溶液加热后,溶液的pH减小
③煤经过气化和液化两个化学变化过程,可变为清洁能源
④古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品
⑤明矾可用于水的杀菌消毒,硫酸钡可用于钡餐透视
⑥单晶硅太阳能电池板可以将太阳能直接转变为电能
⑦刚玉(Al2O3)硬度仅次于金刚石,熔点也相当高,刚玉坩埚可用于熔融碳酸钾
⑧牛奶中加入果汁会产生沉淀,是因为发生了酸碱中和反应
⑨SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
⑩H2、SO2、CO2三种气体都可用浓H2SO4干燥
A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
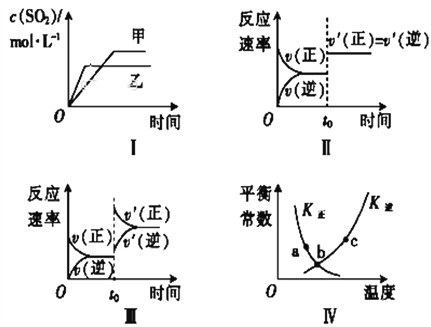
A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
难度: 困难查看答案及解析
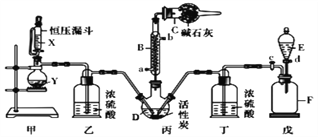
 B. 制取NaHCO3
B. 制取NaHCO3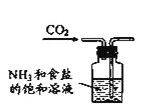
 D. 干燥NaHCO3
D. 干燥NaHCO3 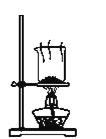
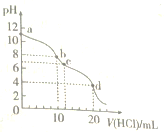
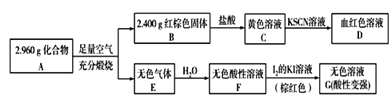
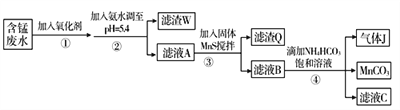
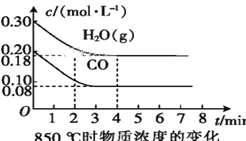

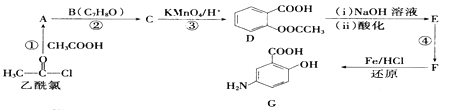
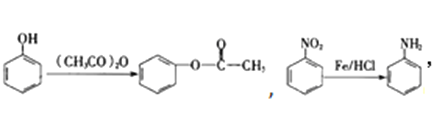 (具有还原性,极易被氧化)。
(具有还原性,极易被氧化)。