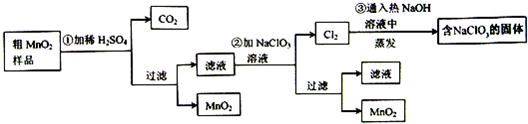
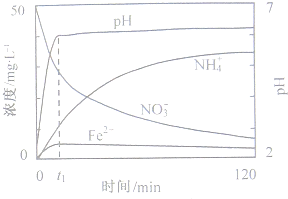
-
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1mol Na2Mn5O10转移2mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是( )
选项 实验操作 现象 解释或结论 ① 过量的Fe粉中加入HNO3,
充分反应后,滴入KSCN溶液溶液呈红色 稀HNO3将Fe氧化为Fe3+ ② AgI沉淀中滴入稀KCl溶液 有白色沉淀出现 AgCl比AgI更难溶 ③ Al箔插入稀HNO3中 无现象 Al箔表面被HNO3氧化,形成致密的氧化膜 ④ 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 试纸变蓝色 浓氨水呈碱性
A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO难度: 中等查看答案及解析
-
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
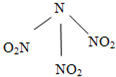
A.分子中N、O间形成的共价键是非极性键
B.分子中四个氧原子共平面
C.该物质既有氧化性又有还原性
D.15.2g该物质含有6.02×1022个原子难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.饱和氯水中:Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol•L-1溶液中:C6H5O-、K+、SO42-、Br-
C.Na2S溶液中:SO42-、K+、Cl-、Cu2+
D.pH=12的溶液中:NO3-、I-、Na+、Al3+难度: 中等查看答案及解析
-
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)⇌2PbCrO4(s)+2H+(aq)△H<0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
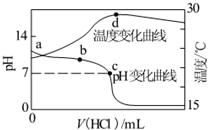
A.a点由水电离出的c(H+)=1.0×10-14mol•L-1
B.b点:c(NH4+)+c=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热难度: 中等查看答案及解析
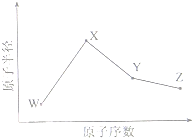
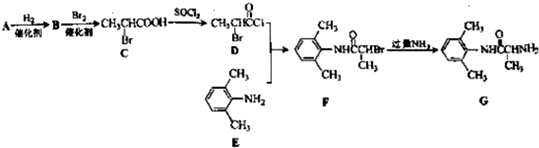
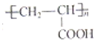 的单体,则A中含有的官能团是______(写名称).B的结构简式是______.
的单体,则A中含有的官能团是______(写名称).B的结构简式是______.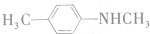 、______、______、______.
、______、______、______.