-
推理是化学学习中常用的思维方法.下列推理正确的是( )
A.酸能使紫色石蕊溶液变红.通入CO2后的紫色石蕊溶液变红,所以CO2是酸
B.酸性溶液的pH小于7.食醋是酸性溶液,所以食醋的pH小于7
C.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
D.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小难度: 中等查看答案及解析
-
化学肥料对农业的高产丰收具有重要的作用.取少量下列化肥,分别加入熟石灰粉末,混合、研磨,其中能嗅到刺激性气味的是( )
A.氯化钾
B.尿素
C.硫酸铵
D.磷矿粉难度: 中等查看答案及解析
-
蒸馒头、炸油条时常用到一种白色物质,它既能中和发酵过程产生的酸,又能引起发泡作用,这种白色物质是( )
A.NaOH
B.NaHCO3
C.Ca(OH)2
D.NaCl难度: 中等查看答案及解析
-
“既满足当代入的需求,又不对后代入满足其自身需求构成危害的发展”是科学发展观的重要内涵之一.下列叙述不符合科学发展观的是( )
A.废旧金属的回收利用,既町以节约金属资源,又可以减少对环境的污染
B.开发太阳能、风能等新能源,既可以解决能源危机,又可以减少对环境的污染
C.为了避免造成土壤污染,应将使用过的一次性塑料饭盒倒入江河湖泊
D.用秸秆制沼气,既能避免焚烧秸秆产生的污染,又能解决生活用燃料问题难度: 中等查看答案及解析
-
美国首颗“嗅碳”卫星在2009年2月24日发射升空过程中因运载火箭出现故障坠毁,这颗卫星的主要任务是绘制全球二氧化碳循环地理分布图.下面关于二氧化碳的叙述不正确的是( )
A.二氧化碳的水溶液能使紫色石蕊试液变红
B.二氧化碳是植物进行光合作用必不可少的原料
C.固态二氧化碳俗称干冰,升华时可吸收大量热,因而可用作制冷剂
D.自然界中的二氧化碳主要消耗途径是植物的呼吸作用难度: 中等查看答案及解析
-
下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )
A.NaCl(Na2CO3),加足量稀盐酸、蒸发、结晶
B.CaCl2(CaCO3),加足量稀硫酸、蒸发、结晶
C.Fe(Cu),加足量稀盐酸、过滤、洗涤、干燥
D.MnO2(KCl),加足量水溶解、过滤、洗涤、干燥难度: 中等查看答案及解析
-
一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示.下列叙述正确的是( )
物 质 A B C D 第一次测得的质量/g 50 4 4.6 1 第二次测得的质量/g 待测 20 23 4.2
A.上述反应属于化合反应
B.该反应C与D的质量变化之比为23:4
C.第二次测得A的质量为12.4g
D.该反应中生成D的质量为4.2g难度: 中等查看答案及解析
-
根据物质分类知识判断,属于纯净物的是( )
A.洁净的空气
B.冰水共存物
C.干净的果汁
D.矿泉水难度: 中等查看答案及解析
-
物质的用途与性质密切相关.下列叙述错误的是( )
A.因为熟石灰能和酸发生反应,所以可用熟石灰改良酸性土壤
B.因为甲醛能使蛋白质变性,起到防腐作用,所以可用甲醛水溶液浸泡水产品
C.因为“洗洁精”有乳化功能,所以可用“洗洁精”洗涤餐具上的油污
D.因为氮气化学性质不活泼,所以可用氮气在食品包装袋内防腐难度: 中等查看答案及解析
-
下列实验设计方案中,可行的是( )
A.用足量稀盐酸除去混在铜粉中的少量镁粉和铝粉
B.向某无色未知溶液中加入BaCl2溶液,证明存在SO42-
C.将H2、O2的混合气体通过盛有灼热氧化铜的试管,以除去氢气
D.用过滤的方法分离NaCl和NaNO3的混合物难度: 中等查看答案及解析
-
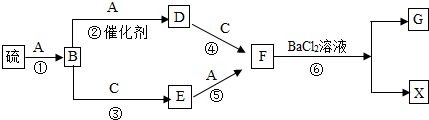
如图各装置能完成相应实验的是( )

A.装置③:制取氧气、氢气等气体
B.装置④:干燥,收集HCl气体
C.装置①:用氯酸钾制氧气
D.装置②:由b进气收集O2或CO2气体难度: 中等查看答案及解析
-
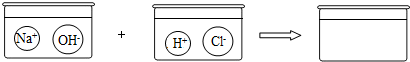
如图,实验桌上放置的两容器中盛有等体积的醋酸和水两种液体.几天后,两者的体积都明显减少,且醋酸比水减少得多.由此现象得出的正确结论是( )
A.醋酸与水都能挥发
B.醋酸比水易挥发
C.醋酸的熔点比水高
D.醋酸的沸点比水高难度: 中等查看答案及解析
-
汽车用铅蓄电池中需要质量分数为28%的稀硫酸.若在实验室中用10g 质量分数为98%的浓硫酸(密度为1.84g/cm3)配制28%的稀硫酸,下列做法或说法正确的是(水的密度近似看作1g/cm3)( )
A.将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌
B.将10g98%的浓硫酸沿烧杯壁慢慢注入盛有25mL水的烧杯中,并用玻璃棒不断搅拌
C.若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28%
D.配制该溶液时,若有浓硫酸沾到手上应立即用氢氧化钠溶液中和难度: 中等查看答案及解析
-
有A、B两种混合粉末,质量分别为m1,m2.A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成.将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg.下列说法正确的是( )(已知:KHCO3+HCl═KCl+CO2↑+H2O;NaHCO3+HCl═NaCl+CO2↑+H2O)
A.m1=m2
B.21m1=25m2
C.混合物A中CaCO3和KHCO3质量比一定为1:1
D.混合物B中MgCO3和NaHCO3质量比可为任意比难度: 中等查看答案及解析
-
某一溶液由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液中的一种,或由其中几种混合形成,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.则下列判断正确的是( )
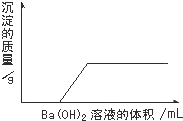
A.该溶液中不可能含有碳酸钠
B.该溶液含有硫酸或盐酸,也可能两种同时含有
C.该溶液中是否含有氯化铜不能确定
D.从上述信息可知该溶液的组成只可能有一种情况难度: 中等查看答案及解析