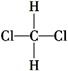
-
下列各组仪器:①漏斗,②容量瓶,③滴定管,④分液漏斗,⑤天平,⑥量筒,⑦胶头滴管,⑧蒸馏烧瓶。常用于物质分离的是( )
A. ①③⑦ B. ②⑥⑦ C. ①④⑧ D. ④⑥⑧
难度: 中等查看答案及解析
-
为了除去括号中的杂质,采用的试剂和方法均为正确的是( )
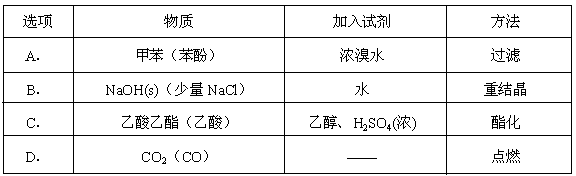
难度: 中等查看答案及解析
-
一定条件下,硝酸铵受热分解的化学方程式为NH4NO3―→HNO3+N2+H2O(未配平),该反应中,被氧化与被还原的氮原子个数之比为( )
A. 5∶3 B. 5∶4 C.1∶1 D. 3∶5
难度: 中等查看答案及解析
-
下列化学用语只能用来表示一种微粒的是( )
A.
 B.
B. 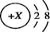 C. CH4O D. C
C. CH4O D. C难度: 简单查看答案及解析
-
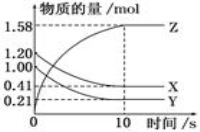
X、Y、Z均为短周期元素,其中X、Z处于同一主族,且Z的原子序数是X的原子序数的两倍;X、Y的最简单离子具有相同的电荷数,但电性相反,且具有相同的电子层结构。下列说法正确的是( )
A. Y、Z处于同一周期 B. X的最高价是+6价
C. 原子半径:Z>Y>X D. 非金属性:X>Y>Z
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是( )
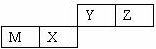
A. 原子半径Z<M
B. Y的最高价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元索周期表中第2 周期,第ⅥA族
难度: 简单查看答案及解析
-
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A. 将SO2通入水中 B. 烧碱溶于水
C. 将HCl通入水中 D. 硫酸氢钠溶于水
难度: 简单查看答案及解析
-
有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )
A.
 1 mol甲分子内含有10 mol共价键
1 mol甲分子内含有10 mol共价键 B.
由乙分子构成的物质不能发生氧化反应
C.
丙分子的二氯取代产物只有三种
D.
 分子丁显然是不可能合成的
分子丁显然是不可能合成的难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是( )
A. 聚丙烯能使酸性高锰酸钾溶液褪色
B. 分馏石油得到的各馏分都是纯净物
C. 蛋白质水解和油脂皂化都是高分子转化成小分子的过程
D. C4H10有2种同分异构体
难度: 简单查看答案及解析
-
下列各组物质,具有相同的最简式,但既不属于同分异构体又不属于同系物的是 ( )
①聚乙烯和乙烯 ②甲醛和葡萄糖 ③淀粉和纤维素 ④蔗糖和麦芽糖 ⑤聚乙烯和聚氯乙烯
A. ①②⑤ B. ①②③ C. ①④⑤ D. ①②③⑤
难度: 简单查看答案及解析
-
下列除去杂质的方法正确的是( )
A. 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离
B. 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏
C. 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
D. 除去乙醇中少量的乙酸:加足量生石灰,蒸馏
难度: 中等查看答案及解析
-
有关物质性质及用途的说法,正确的是( )
A.甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
B.将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应
C.牡丹籽油是一种优良的植物油脂,它可使酸性高锰酸钾溶液褪色
D.等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CH2═CH2和CH3CH2C1都属于烃 B.乙烯和乙烷都能发生加聚反应
C.米酒变酸的过程涉及氧化反应 D.未成熟的苹果遇碘水不会变蓝
难度: 简单查看答案及解析
-
下列几组顺序排列不正确的是( )
A. 沸点高低:HI>HBr>HCl>HF
B. 热稳定性大小:HF>H2O>NH3>PH3
C. 熔点高低:金刚石>食盐>金属钠>冰
D. 微粒半径大小:S2->Cl->F->Na+>Al3+
难度: 简单查看答案及解析
-
根据如表数据,则与HClO3比,HClO具有的是( )
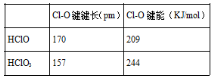
A. 更高的沸点 B. 更强的酸性
C. Cl-O断裂放出的能量更少 D. 更易放出原子氧
难度: 简单查看答案及解析
-
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P−H键键能比N−H键键能低。下列判断错误的是( )
A. PH3分子呈三角锥形
B. PH3分子是极性分子
C. PH3沸点低于NH3沸点,因为P-H键键能低
D. PH3分子稳定性低于NH3分子,因为N-H键键能高
难度: 简单查看答案及解析
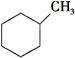 B.
B. C.
C.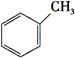
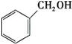 c.
c. 
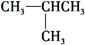 和
和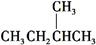 ④
④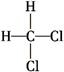 和
和