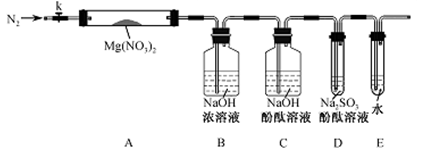
-
化学与社会、生产、生活紧切相关。下列说法正确的是
A.石英只能用于生产光导纤维
B.从海水提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.戊烷(C5H12)有两种同分异构体
C.乙烯、聚氯乙烯和苯分子均含有碳碳双键
D.糖类、油脂和蛋白质均可发生水解反应
难度: 中等查看答案及解析
-
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH—=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)c(OH—)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的PH=13
难度: 中等查看答案及解析
-
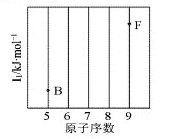
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
A.原子半径Z<M
B.Y的最离价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元索周期表中第2 周期、第ⅥA族
难度: 困难查看答案及解析
-
下列有关试验的做法不正确的是
A.分液时,分液漏斗的上层液体应由上口到出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配置0.1000 mol·L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
难度: 中等查看答案及解析
-
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
mCeO2+ xH2+ xCO
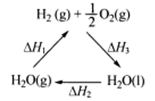
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
难度: 中等查看答案及解析
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
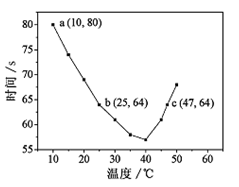
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该试验的指示剂
难度: 中等查看答案及解析
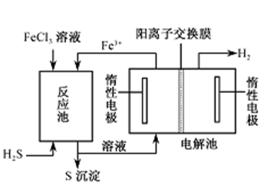
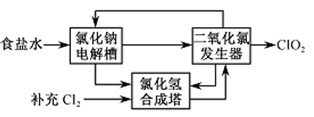
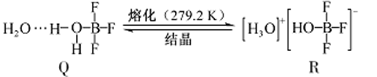

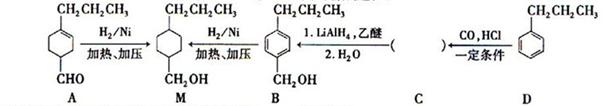
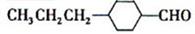 和______(写结构简式)生成
和______(写结构简式)生成