-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe.有关该电池的下列说法中,正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS难度: 中等查看答案及解析
-
下列化学反应的△H>O是( )
A.2H2O(l)2H2(g)↑+O2(g)↑
B.Mg(s)+2H+(aq)═Mg2++H2↑
C.2Fe(s)+O2(g)+2H2O(l)═2Fe(OH)2(s)
D.H2(g)+Cl2(g)═2HCl(g)难度: 中等查看答案及解析
-
下列热化学方程式中的反应热又为燃烧热的是( )
A.H2(g)+O2(g)=H2O(g)△H=-241.0kJ/mol
B.CH4(g)+O2(g)=CO(g)+2H2O(l)△=-607.38kJ/mol
C.C2H4(g)+3O2(g)=2CO2+2H2O(l)△=-1411.0kJ/mol
D.H+(aq)+OH-(aq)=H2O(l)△=-57.3kJ/mol难度: 中等查看答案及解析
-
如图是某条件下N2与H2反应过程中能量变化的曲线图.根据图象判断下列叙述中正确的是( )
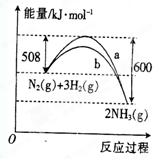
A.该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=+92kJ•mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热数值会减小
D.反应2NH3(g)=N2(g)+3H2(g)△H=+92kJ•mol-1难度: 中等查看答案及解析
-
已知4NH3+5O2═4NO+6H2O,反应速率分别用υ(NH3)、υ(O2)、υ(NO)υ(H2O)表示,下列关系正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
一般气体的熵值大于液体的熵值,液体的熵值大于固体的熵值.下列变化过程中,熵在减小(即△S<O)的是( )
高温.
A.H2O(s)→H2O(l)→H2O(g)
B.CaCO3═CaO+CO2↑
C.2Na+2H2O═2Na++2OH-+H2↑
D.2H2(g)+O2(g)═2H2O(l)难度: 中等查看答案及解析
-
已知Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中溶液最先变浑浊的是( )
组号 参加反应的物质 反应温度
(℃)Na2S2O3 H2SO4 H2O V(mL) c(mol/L) V(mL) c(mol/L) V(mL) A 10 5 0.1 5 0.1 5 B 10 5 0.1 5 0.1 5 C 30 5 0.2 5 0.2 5 D 30 5 0.2 5 0.2 10
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
相同温度下,在A、B、C、D四个相同容积的密闭容器中,按下列物质的量分别加入反应物和生成物,发生可逆反应2X(g)+Y(g)=3Z(g)+W(g),达到平衡后,有一容积中Y物质的量浓度与另外三个容积中Y物质的量浓度不同,这个容积是( )
A.2molX、1molY、0molZ、0molW
B.3molZ、1molW、0molX、0molY
C.2molX、1molY、3molZ、1molZ
D.1molX、0.5molY、1.5molZ、0.5molW难度: 中等查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)⇌I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法不正确的是 ( )
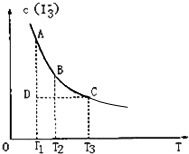
A.反应I2(aq)+I-(aq)⇌I3-(aq)的△H<0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大难度: 中等查看答案及解析
-
下列方程式正确的是( )
A.CO32-+2H2O⇌H2CO3+2OH-
B.NH4++CH3COO-+H2O═CH3COOH+NH3•H2O
C.H2CO3⇌CO32-+2H+
D.NH4++AlO2-+2H2O═Al(OH)3↓+NH3•H2O难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍
B.将NaOH溶液和氨水各稀释一倍,两者的OH-浓度均减小到原来的
C.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸
D.弱电解质溶液的导电能力也可能比强电解质溶液的强难度: 中等查看答案及解析
-
常温下,下列盐溶于水时,能使水的电离程度增大且c(H+)也增大的是( )
A.NaHSO4
B.KAl(SO4)2
C.NaHCO3
D.CH3COONa难度: 中等查看答案及解析
-
常温下,在pH=1的HCl溶液中,水电离产生的c(OH-)和c(H+)都为( )
A.0.1mol/L
B.1mol/L
C.10-131mol/L
D.不能确定难度: 中等查看答案及解析
-
下列离子组在溶液中能大量共存的是( )
A.Al3+、K+、CO32-、Cl-
B.Mg2+、NO3-、SO42-、H+
C.Fe3+、Na+、ClO-、SO42-
D.AlO2-、Na+、SO42- HCO3-难度: 中等查看答案及解析
-
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,溶液中离子浓度关系不正确的是( )
A.c(M+)=c(HA)+c(A-)
B.c(M+)>c(H+)>c(A-)>c(OH-)
C.c(OH-)=c(H+)+c(HA)
D.c(M+)+c(H+)=c(OH-)+c(A-)难度: 中等查看答案及解析
-
为除去MgCl2酸性溶液中的Fe3+,不可以使用的试剂是(已知:Mg(OH)2的Ksp:5.6×10 -12,Fe(OH)3的Ksp:4.0×10 -38 )( )
A.NH3•H2O
B.MgO
C.Mg(OH)2
D.MgCO3难度: 中等查看答案及解析
-
某温下,在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )
A.[Ba2+]=[SO42-]=Ksp½
B.[Ba2+]•[SO42-]>Ksp[Ba2+]=[SO42-]
C.[Ba2+]•[SO42-]=Ksp[Ba2+]>[SO42-]
D.[Ba2+]•[SO42-]≠Ksp[Ba2+]<[SO42-]难度: 中等查看答案及解析
-
电子计算器所用的纽扣电池中,还原剂是锌,氧化剂是Ag2O,电解质溶液为KOH溶液;其电极反应如下.Zn-2e-+2OH-═ZnO+H2O,
═2Ag+2OH-.
下列叙述正确的是( )
A.锌为正极
B.放电时,负极区溶液的pH增大
C.锌为负极
D.放电时,正极区溶液的pH减小难度: 中等查看答案及解析
-
根据如图,可判断出下列离子方程式中错误的是( )
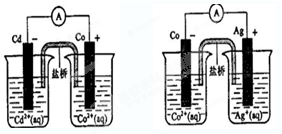
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Cd(s)+Co2+(aq)=Cd2+(aq)+Co(s)
C.2Ag+( aq)+Cd( s)=2Ag(s)+Cd2+(aq)
D.2 Ag+(aq)+Co(s)=2 Ag(s)+Co2+(aq)难度: 中等查看答案及解析
-
下列装置中(杯中均盛有海水)能使铁受到保护不被腐蚀的是( )

A.①③
B.②④
C.①②
D.③④难度: 中等查看答案及解析
-
用惰性电极电解下列溶液,在阴、阳两极生成气体的体积比为1:1的是( )
A.NaCl溶液
B.CuCl2溶液
C.CuSO4溶液
D.KOH溶液难度: 中等查看答案及解析
-
控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极难度: 中等查看答案及解析
