-
“能源分类相关图”如图所示,四组能源选项中全部符合图中阴影部分的能源是( )

A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
难度: 简单查看答案及解析
-
下列反应中可判断为可逆反应的是( )
A.氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气
B.氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气
C.单质溴可以置换出碘,氯气又可以置换出溴
D.氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气
难度: 简单查看答案及解析
-
在化工生产中,如果再加快反应速率,应该优先考虑的科研方向是( )
A.提高设备强度,以便加压 B.选择适宜的催化剂
C.采用高温 D.用块状反应物代替粉末状反应物
难度: 简单查看答案及解析
-
下列是4位同学在学习“化学反应速率与化学平衡”一章后的观点,你认为不正确的是( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
难度: 简单查看答案及解析
-
已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则关于方程式2H2O(l)===2H2(g)+O2(g)的ΔH的说法中正确的是( )
A.方程式中的化学计量数表示分子数 B.该反应ΔH大于零
C.该反应ΔH=-571.6 kJ/mol D.该反应可表示36 g水分解时的热效应
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
难度: 简单查看答案及解析
-
在体积不变的密闭容器中,2A(g)+2B(g)
3C(g)+D(g)达到平衡状态的标志是( )
A.单位时间内生成2n mol A,同时生成n mol D
B.容器内压强不随时间而变化
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内混合气体密度不随时间而变化
难度: 简单查看答案及解析
-
下列说法完全正确的是 ( )
A.放热反应均是自发反应
B.ΔS 为正值的反应均是自发反应
C.物质的量增加的反应,ΔS 为正值
D.如果ΔH和ΔS 均为正值,当温度升高时,反应可能自发进行
难度: 简单查看答案及解析
-
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线。
以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量 ②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量 ④NH4Cl溶液中逐渐加入适量NaOH固体
A
B
C
A
①
②
③
B
④
②③
①
C
③
①②
④
D
②
①③
④
难度: 简单查看答案及解析
-
将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2 B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3 D.3 mol SO2+1 mol SO3
难度: 简单查看答案及解析
-
在一真空密闭容器中盛有1 mol PCl5,加热到200 ℃,发生反应:PCl5(g)
PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
A.m>n B.m<n C.m=n D.无法比较
难度: 简单查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol/L,c(HI)=4 mol/L,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
难度: 简单查看答案及解析
-
2A(s)+3B(g)
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
难度: 简单查看答案及解析
-
在不同条件下分别测得反应2SO2+O2
2SO3的化学反应速率,其中表示该反应进行的最快的是( )
A.v(SO2)=4 mol/(L·min) B.v(O2)=3 mol/(L·min)
C.v(SO2)=0.1 mol/(L·s) D.v(O2)=0.1 mol/(L·s)
难度: 简单查看答案及解析
-
可逆反应mA(g)
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )

A.m>n,Q>0 B.m>n+p,Q>0
C.m>n,Q<0 D.m<n+p,Q<0
难度: 简单查看答案及解析
-
在一密闭容器中有如下反应:aX(g)+bY(g)
nW(g) ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
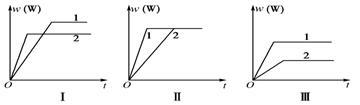
其中,w(W)表示W在反应混合物中的体积分数,t表示反应时间。下列分析正确的是( )
A.图Ⅰ可能是不同压强对反应的影响,且p1>p2,a+b<n
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且Ⅰ使用的催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
难度: 简单查看答案及解析
