-
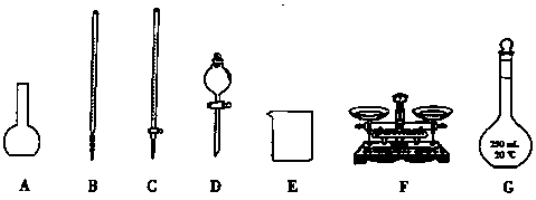
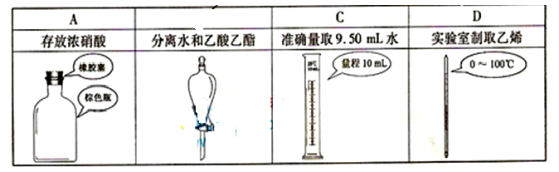
下列选用的相关仪器符合实验要求的是
难度: 简单查看答案及解析
-
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
选项
实验目的
主要仪器
试剂
A
分离Br2和CCl4的混合物
分液漏斗、烧杯
Br2和CCl4的混合物、蒸馏水
B
实验室制取H2
试管、带导管的橡皮塞
锌粒、稀HNO3
C
鉴别葡萄糖和蔗糖
试管、烧杯、酒精灯
葡萄糖溶液、蔗糖溶液、
银氨溶液
D
测定NaOH溶液的浓度
滴定管、锥形瓶、烧杯
NaOH溶液、
0.100 0 mol·L-1盐酸
难度: 中等查看答案及解析
-
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A.3个 B.4个 C.5个 D.全部正确
难度: 困难查看答案及解析
-
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
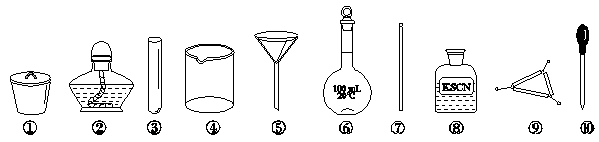
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
难度: 中等查看答案及解析
-
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是

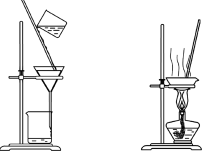
甲 乙 丙 丁
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后
=11,则溶液中
=
B.参加反应的氯气的物质的量等于
a mol
C.改变温度,产物中KClO的最大理论产量为
a mol
D.改变温度,产物中KClO3的最大理论产量为
a mol
难度: 困难查看答案及解析