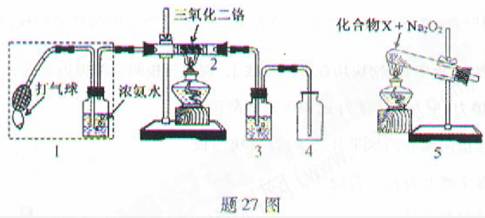
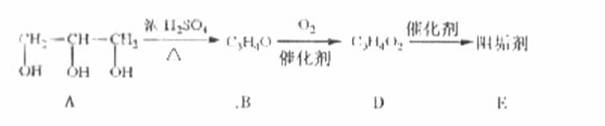
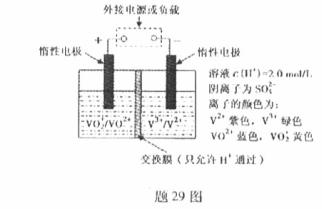
-
减缓温室气体排放是2009年哥本哈根气候变化会议的议题。下列反应不产生温室气体的是
A.用纯碱制玻璃 B.用煤炭作燃料
C.用铁矿石炼铁 D.用氨制碳酸铵
难度: 中等查看答案及解析
-
下列实验装置(固定装置略去)和操作正确的是
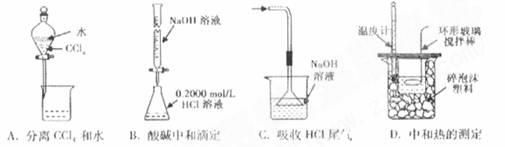
难度: 中等查看答案及解析
-
下列叙述正确的是
A.铝制容器可盛装热的H2SO4
B.Agl胶体在电场中自由运动
C.K与水反应比Li与水反应剧烈
D.红磷在过量Cl2中燃烧生成PCl3
难度: 中等查看答案及解析
-
能鉴别Mg、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是
A.HNO3 B.KOH C.BaCl2 D.NaClO
难度: 中等查看答案及解析
-
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
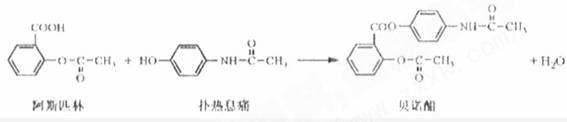
下列叙述错误的是
A.FeCl3 溶液可区别阿司匹林和扑热息痛
B.1mol阿司匹林最多可消耗2mol NaOH
C.常温下贝诺酯在水中的溶解度小于扑热息痛
D.C6H7NO 是扑热息痛发生类似脂水解反应的产物
难度: 中等查看答案及解析
-
已知
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:

则表中a为
A.404 B.260 C.230 D.200
难度: 中等查看答案及解析