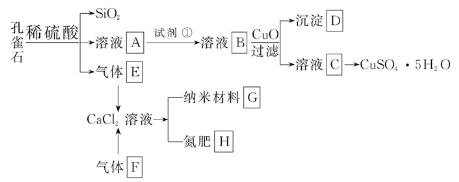
-
下列有关物质应用的说法中不正确的是( )
A.碳酸钠用于治疗胃溃疡病人的胃酸过多症
B.Na2O2用作呼吸面具的供氧剂
C.明矾用于净化生活用水
D.Fe2O3用于制作红色染料
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.明矾和Cl2常用于自来水的净化和杀菌消毒,两者的反应原理相同
B.工业上制备镁是用电解熔融的MgCl2来完成的
C.131I是质子数为131的一种核素
D.用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3
难度: 中等查看答案及解析
-
下列有关金属的说法中正确的是( )
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②纯铁比生铁抗腐蚀性更强
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素
A.②④⑤⑥ B.②③④⑤ C.①③④⑤ D.①②⑤⑥
难度: 中等查看答案及解析
-
下列实验操作或对事实叙述正确的是( )
A.某无色溶液焰色反应呈黄色,则其一定为钠盐溶液
B.用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
C.加热法不可区分I2和KMnO4两种紫色固体
D.只用水即可鉴别固体Na2CO3和NaHCO3
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A.向稀盐酸溶液中加铁:3Fe+6H+=3Fe3++3H2↑
B.FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.向氯化铝溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓
D.向偏铝酸钠溶液中通入过量CO2:
难度: 中等查看答案及解析
-
下列各组离子在指定条件下一定能大量共存的是( )
A.在加入铝粉能产生氢气的溶液中:
B.能使淀粉碘化钾试纸变蓝的溶液中:
C.能使红色石蕊试纸变蓝的溶液中:
D.在含有大量Fe3+的溶液中:
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤Cu与HNO3溶液反应,由于HNO3浓度不同可发生不同的氧化还原反应
A.都正确 B.②③④⑤ C.②③⑤ D.④⑤
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能知道其正确与否。以下几种类推结论中正确的是( )
A.金属镁失火不能用二氧化碳灭火器扑灭;金属钠失火也不能用二氧化碳灭火
B.加热Ag2O可以得到单质银;加热CuO也可制取单质铜
C.工业上用电解熔融MgCl2的方法制取金属镁;故也可用电解熔融AlCl3的方法制取金属铝
D.Al和S直接化合可以得到Al2S3;Fe与S直接化合也可得到Fe2S3
难度: 中等查看答案及解析
-
下列实验现象与结论相符合的是( )
A.在溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,则溶液中一定存在
B.在铝热剂中加入少量稀盐酸,再迅速滴加KSCN溶液,未出现红色,不能说明铝热剂中是否含有Fe2O3
C.某盐焰色反应火焰为黄色,则该盐金属元素一定只有钠元素
D.如图所示,放置一段时间后,饱和CuSO4溶液中出现蓝色晶体,说明CaO有一定的脱水性

难度: 中等查看答案及解析
-
.化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有( )
①氢氧化亚铁在空气中最终变为灰绿色;
②淀粉溶液遇单质碘变为蓝色;
③向硫酸铁溶液中加入KSCN溶液变为红色;
④新制氯水久置后变为无色;
⑤无水硫酸铜吸收水蒸气变成浅绿色;
⑥品红溶液通入过量二氧化硫后褪色。
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
选 项
化合物 A B C D
Y CO2 Fe2O3 C2H5OH FeCl3
W MgO Al2O3 C2H5ONa CuCl2
难度: 中等查看答案及解析
-
将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。再经充分反应后,溶液中一定含有的金属离子是( )
A.Fe3+和Cu2+ B.Fe2+和Cu2+ C.Fe2+ D.Fe2+和Fe3+
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.Cl2和SO2的漂白原理不同,混合使用效果更好
B.FeCl2和Fe(OH)3都不能通过化合反应直接制取
C.用铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中不含Na+
D.常温下,向饱和的Na2CO3溶液中通入大量的CO2气体,结果有晶体析出
难度: 中等查看答案及解析
-
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,下列组合不可能的是( )
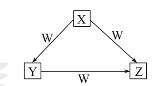
X Y Z W
A C CO CO2 O2
B Na Na2O Na2O2 O2
C AlCl3 Al(OH)3 NaAlO2 NaOH
D Fe FeCl2 FeCl3 Cl2
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.Fe溶于一定量稀硝酸中可能生成Fe3+和Fe2+
B.Al(OH)3既能溶于盐酸也能溶于烧碱溶液
C.Cu和过量的S反应生成Cu2S
D.NaHCO3和Na2CO3受热都分解出CO2
难度: 中等查看答案及解析
-
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为2KMnO4+10FeSO4+ 8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如下图所示。

则下列有关说法不正确的是( )
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色
难度: 中等查看答案及解析