-
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A. 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物
B. HC1O、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
C. 漂白粉、福尔马林、冰水、王水、氯水均为混合物
D. Na2O、NaOH、Na2CO3、NaCl、Na2SO4、Na2O2都属于钠的含氧化合物
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O
B. 向NH4HSO3溶液中滴加足量KOH溶液:NH4++OH-=NH3•h2o
C. 在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,能使淀粉溶液变蓝:2I-+H2O2+2H+=I2+2H2O
D. 盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为:Ca2++CO32-=CaCO3↓
难度: 困难查看答案及解析
-
向含有0.2molFeI2的溶液中加入amolBr2。下列叙述不正确的是( )
A. 当a=0.1时,发生的反应为2I-+ Br2=I2 +2Br-
B. 当 a=0.25时,发生的反应为 4Fe2++6I-+5Br2=4Fe3++3I2+10Br-
C. 当溶液中I-有一半被氧化时,c(I-)∶c(Br-)=l∶1
D. 当0.2<a<0.3时(不考虑碘与水反应),溶液中各离子浓度的关系为:2c(Fe2+) + 3c(Fe3+) +c(H+)=c(Br-)+ c(OH-)
难度: 困难查看答案及解析
-
下列离子组能大量共存且加入相应试剂后发生反应的离子方程式正确的是( )
选项
离子组
试剂
离子方程式
A
Fe2+、NO3-、K+
稀硫酸
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
B
Fe3+、I-、ClO-
NaOH溶液
Fe3++3OH-=Fe(OH)3↓
C
Ba2+、HCO3-、Cl-
NaOH溶液
HCO3-+ OH-=CO32-+H2O
D
Ag+、NO3-、Br-
过量浓氨水
Ag++OH-=AgOH↓
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某金属和硝酸反应,已知被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若己知还原产物唯一,则还原产物为
A. N2 B. N2O C. NO D. NO2
难度: 困难查看答案及解析
-
向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是( )
A. 二氧化碳:Mg2+、Al3+、Cl-、NO3- B. 二氧化硫:Na+、NH4+、SO32-、Cl-
C. 氯化氢: H+、K+、MnO4-、SO42- D. 氯气:K+、Na+、AlO2-、S2-
难度: 困难查看答案及解析
-
NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是
A. 转移电子4.8NA个 B. 生成气体的体积42.56 L(标准状况)
C. 还原剂比氧化剂多0.2 mol D. 被还原的氮原子是ll.2 g
难度: 困难查看答案及解析
-
生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用
D. 胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小
难度: 简单查看答案及解析
-
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示)。下列关于苯(
)的说法不正确的是

A. 属于电解质 B. 属于共价化合物
C. 可以做萃取剂 D. 可以做还原剂
难度: 中等查看答案及解析
-
人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是
A. 铁、金属活动性顺序表 B. 金、质量守恒定律
C. 银、元素周期律 D. 铜、金属密度顺序表
难度: 中等查看答案及解析
-
物质在化学反应前后,可能发生变化的是
A. 原子总数 B. 质子总数 C. 电子总数 D. 分子总数
难度: 简单查看答案及解析
-
下列叙述中不正确的是
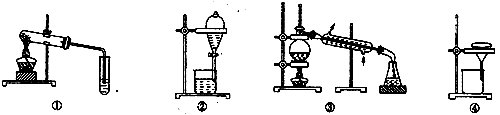
A. 可用装置①鉴别碳酸钠和碳酸氢钠 B. 可用装置②分离汽油和水的混合物
C. 可用装置③从海水中蒸馏得到淡水 D. 可用装置④把胶体粒子从分散系中分离出来
难度: 中等查看答案及解析
-
某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,下列有关叙述正确的是
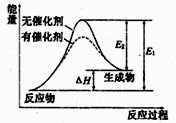
A. 该反应为放热反应 B. 催化剂能降低该反应的ΔH
C. E2可表示该反应逆反应的活化能 D. ΔH=E2-E1
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. l L1 mol/L的盐酸溶液中,所含氯化氢分子数为NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
难度: 中等查看答案及解析
-
下列各组物质,无论前者是否过量,都能用同一离子方程式表示的是(还原性 Fe2+>Br->Cl-)
A. 稀盐酸,碳酸钠溶液 B. 稀盐酸,碳酸氢钠溶液
C. 碳酸氢钠溶液,澄淸石灰水 D. 氯水,溴化亚铁溶液
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1mol·L-1NaOH溶液:K+、Ba2+、Cl-、HCO3-
B. 0.1mol·L-1Na2CO3溶液:K+、NH4+、NO3-、SO42-
C. 0.1mol·L-1FeCl3溶液:K+、Na+、I-、SCN-
D. 0.1mol·L-1HCl的溶液:Ca2+、Na+、C1O-、NO3-
难度: 困难查看答案及解析
-
下列反应所得溶液中一定只含一种溶质的是
A. 向稀硝酸中加入铁粉
B. 向氯化铝溶液中加入过量的氨水
C. 向NaOH溶液中通入CO2气体
D. 向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
难度: 简单查看答案及解析
-
向以下六种饱和溶液中分别持续通入CO2,最终得到沉淀或析出晶体的一组是
①Ba(NO3)2 ②Ca(OH)2 ③Na2SiO3 ④NaA1O2 ⑤Na2CO3 ⑥ NH3和NaCl
A. ①③④⑥ B. ②③④⑥ C. ③④⑤⑥ D. ①②③⑤
难度: 困难查看答案及解析
-
工业上曾经通过反应“3Fe + 4NaOH
Fe3O4+ 2H2↑+4Na↑” 生产金属钠。下列有关说法正确的是
A. 用磁铁可以将Fe与Fe3O4分离 B. 将生成的气体在空气中冷却可获得钠
C. 该反应条件下铁的氧化性比钠强 D. 每生成lmolH2,转移的电子数约为4×6.02×1023
难度: 困难查看答案及解析
-
有3份等质量的小苏打,第1份直接与盐酸恰好完全反应;第2份首先加热,使其部分分解后,再与足量盐酸恰好完全反应;第3份首先加热,使其完全分解后,再与足量盐酸恰好完全反应。假若盐酸的物质的量浓度相同,消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3 >V1 D. V1=V2=V3
难度: 困难查看答案及解析
-
将一粒黄豆大小的金属钠,投入含饱和食盐水的烧杯中,下列实验现象不正确的是
A. 反应后的水溶液可以使酚酞变红
B. 钠跟食盐水反应比与水反应更剧烈,并放出热量,发出嘶嘶声
C. 钠熔成一个闪亮的小球,并在液面上向各方向迅速游动最后消失
D. 食盐水出现浑浊现象
难度: 困难查看答案及解析
-
若以w1和w2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知2a=b,则下列判断正确的是(氨水的密度比纯水的小)
A. 2 w1=w2 B. 2w2=w1 C. w2>2w1 D. w1<w2<2w1
难度: 简单查看答案及解析
-
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,它的用途、物理性质与NaCl极为相似。相关化学性质如图所示,下列说法不正确的是
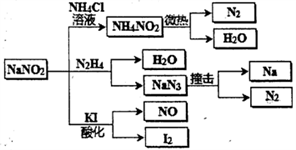
A. NaNO2稳定性大于NH4NO2
B. NaNO2与N2H4反应中,NaNO2是氧化剂
C. 可用KI-淀粉和食醋鉴别NaNO2 和NaCl
D. 分解NaN3盐每产生1molN2转移6mole-
难度: 困难查看答案及解析
-
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与 NaClO的物质的量之比为1∶16,则x的值为
A. 2 B. 3 C. 4 D. 5
难度: 困难查看答案及解析
-
若20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中NO3-的物质的量浓度为
A.
B.
C.
D.
难度: 困难查看答案及解析
