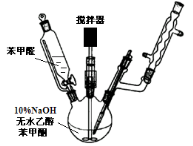
-
化学与人类生产、生活,社会可持续发展密切相关。下列说法正确的是
A.蔬菜表面洒少许福尔马林,可保鲜和消毒
B.绿色食品就是不使用化肥农药,不含任何化学物质的食品
C.推广纳米TiO2光触媒技术铺设“生态马路”,将汽车尾气转化为无害物质
D.推广使用煤液化技术可减少二氧化碳温室气体气体的排放
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.含18个中子的氯原子的核素符号:17 35Cl
B.14C的原子结构示意图:
C.次氯酸的电子式:
D.间羟基苯甲酸的结构简式:
难度: 简单查看答案及解析
-
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.1.0mol·L -1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42-
B.c(H+)/c(OH-)=10-11的溶液:Na+、Ba2+、NO3-、Cl-
C.滴入酚酞显红色的溶液:Ca2+、Al3+、NO3-、HCO3-
D.滴入碘化钾淀粉溶液显蓝色的溶液:Na+、Fe2+、ClO-、SO42-
难度: 中等查看答案及解析
-
下列有关物质性质、应用的说法正确的是
A.小苏打可与酸反应,可用作治疗胃酸过多的药剂
B.氯化铝是电解质,可电解其水溶液获得金属铝
C.SO2具有漂白性,可用于将银耳漂白为“雪耳”
D.二氧化硅具有导电性,可用于生产光导纤维
难度: 中等查看答案及解析
-
下列实验装置或操作能达到实验目的
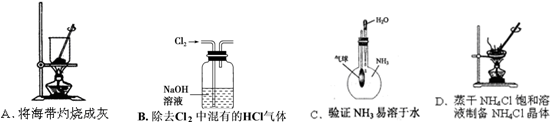
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3
D.若甲为NaHCO3,则丁可能是HCl
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA
C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D.a mol·L—1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl—的数目为3NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
B.向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
D.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2
4Li+2SOCl2。下列说法正确的是
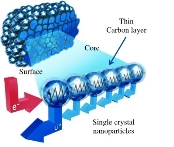
A.电池的电解液可为LiCl水溶液
B.该电池放电时,负极发生还原反应
C.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2
D.放电时电子从负极经外电路流向正极,再从正极经
电解质流向负极
难度: 中等查看答案及解析
-
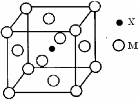
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,其中X原子最外层电子数是其电子层数的2倍。下列说法正确的是
A.四种元素的原子半径大小rY>rW>rX>rZ
B.元素X的含氧酸只有一种,元素Y则有两种
C.元素Z的气态氢化物的稳定性比元素Y的强
D.元素Y和W的氧化物是导致酸雨的主要原因
难度: 中等查看答案及解析
-
下列说法正确的是
A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4
C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小
D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0
难度: 中等查看答案及解析
-
普罗加比对瘫痫、痉挛和运动失调均有良好的治疗效果,其结构如下图所示,有关普罗加比的说法正确的是
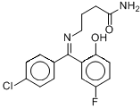
A.该分子在1H核磁共振谱中有12个峰
B.久置在空气中的普罗加比会因氧化而变质
C.1 mol普罗加比最多可与3 mol NaOH反应
D.一定条件下,1mol普罗加比最多能与2mol H2发生加成反应
难度: 中等查看答案及解析
-
下列依据相关实验得出的结论正确的是
A.向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42-
B.向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强
C.向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀。证明葡萄糖中不含醛基
D.检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液
难度: 中等查看答案及解析
-
常温下,下列各溶液的叙述中正确的是
A.NaHSO3与Na2SO3混合溶液中:3c(Na+) = c(HSO3-) + c(SO32-)
B.0.1mol·L-1的醋酸钠溶液20 mL与0.1mol·L-1盐酸10 mL混合后溶液显酸性
c (CH3COO-)>c (Cl-)>c (CH3COOH)>c (H+)
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:
c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D.向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入0.2molCO2气体,溶液中:
c(Na+) > c(CO32-) > c(HCO3-) > c(OH-) > c(H+)
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10 L恒容密闭容器中,发生反应:
X(g)+Y(g)
2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.反应前2 min的平均速率ν(Z) = 2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)<0.24 mol
D.其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大
难度: 中等查看答案及解析
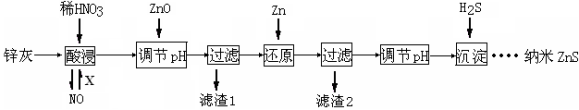
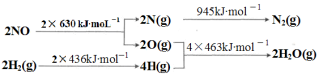
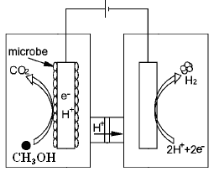
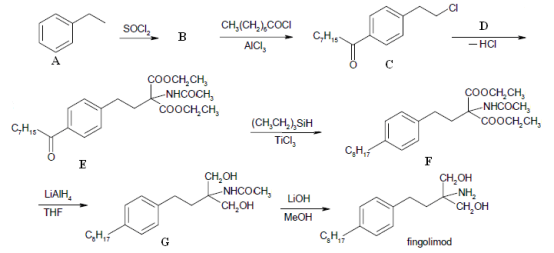
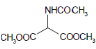 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: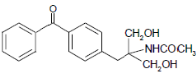 (无机原料任选)。合成路线流程图示例如下:
(无机原料任选)。合成路线流程图示例如下: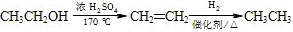
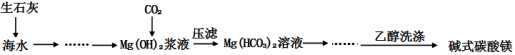
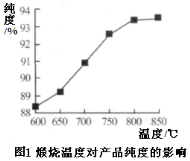
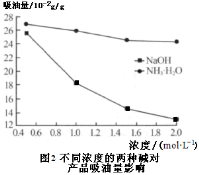
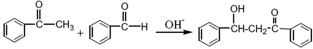
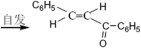 (查尔酮)
(查尔酮)