-
中新网2009年12月7日电《联合国气候变化框架公约》第15次缔约方会议暨《京都议定书》第5次缔约方会议在丹麦首都哥本哈根召开,这一会议也被称为哥本哈根联合国气候变化大会。减排成为国际社会热议的话题。下列说法正确的是:( )
①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量。
②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一。
③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾。
④太阳能、风能、水能、生物质能、地热能和海洋能都不属于可再生能源。
难度: 简单查看答案及解析
-
下列叙述中,能证明某物质是弱电解质的是: ( )
A.熔化时不导电
B.水溶液的导电能力很差
C.不是离子化物,而是极性共价化合物
D.溶液中已电离的离子和未电离的分子共存
难度: 简单查看答案及解析
-
用石墨作电极,电解1 mol / L下列物质的溶液,溶液的pH值保持不变的是( )
A.HCl B. NaOH C.Na2SO4 D. KCl
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-,向右移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入NaOH溶液 D. 将水加热到100℃,使pH=6
难度: 简单查看答案及解析
-
已知:①lmolH
分子中化学键断裂时需要吸收436 kJ的能量②1 mol C1
分子中化学键断裂时需要吸收243 kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431 kJ的能量下列叙述中正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是:
H2( g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的
C.氢气和氯气反应生成2mol氯化氢气体,反应的
D.氢气和氯气反应生成1 mol氯化氢气气体,反应的
难度: 简单查看答案及解析
-
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是 ( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
难度: 简单查看答案及解析
-
在给定的条件下,下列各离子组能大量共存的是 ( )
A. 滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN-
B. 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
C. PH=12的溶液 K+、ClO-、NO3-、H+
D. pH=1的溶液 Cu2+、Na+、Mg2+、Cl-
难度: 简单查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液 ( )
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
难度: 简单查看答案及解析
-
下列事实可以用勒夏特列原理解释的是 ( )
A.新制的氯水在光照条件下颜色变浅
B.使用催化剂,提高合成氨的产率
C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D.H2、I2、HI平衡混合气体加压后颜色变深
难度: 简单查看答案及解析
-
在一个密闭容器中发生如下反应:2SO2 (g)+O2(g)
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是 ( )
A.C(SO3) = 0.4 mol·L-1 B.C(SO3) + C(SO2) = 0.15 mol·L-1
C.C(O2) = 0.3 mol·L-1 D.C(SO3) + C(SO2) = 0.4 mol·L-1
难度: 简单查看答案及解析
-
用来表示可逆反应:2A(g)+B(g)
3C(g)(正反应放热)的正确图象是下图中的 ( )
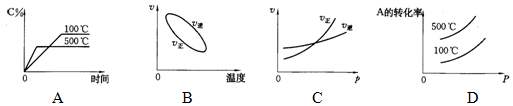
难度: 简单查看答案及解析
-
关于小苏打水溶液的表述正确的是 ( )
A、c (Na+)=c (HCO3-) + c (CO32-) + 2c (H2CO3)
B、c (Na+) + c (H+) = c (HCO3-) +c (CO32-) +c (OH-)
C、HCO3- 的电离程度大于HCO3-的水解程度
D、存在的电离有:NaHCO3=Na++HCO3—,HCO3—
H++CO32—,
H2O
H++OH—
难度: 简单查看答案及解析
-
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
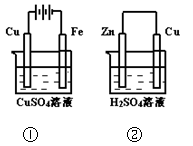
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上生成物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;
②中负极:2H+ + 2e一= H2↑
D.溶液的pH:①不变;②增大
难度: 简单查看答案及解析
-
下列实验基本操作正确的是 ( )
A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL;
B.配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量
C.用广范PH试纸测某 溶液PH=3.6
D.用玻璃棒蘸取溶液滴到湿润的pH试纸上,测其pH
难度: 简单查看答案及解析
-
mA(g)+nB(g)
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
①体系的压强不再改变 ②绝热体系的温度不再改变 ③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率vA: vB: vC: vD = m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥
难度: 简单查看答案及解析
-
向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-)。其平衡关系如下:
Cr3++3OH-
Cr(OH)3
CrO22- + H+ + H2O
(紫色) (灰绿色) (亮绿色)
向0. 05mo1·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是 ( )
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
难度: 简单查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- =Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.②④ B.②③ C.①② D.③④
难度: 简单查看答案及解析
-
下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
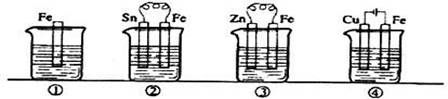
A、③>②>④>① B、②>①>③>④ C、④>②>③>① D、④>②>①>③
难度: 简单查看答案及解析
-
向0.1 mol·L-1的CH3COOH溶液中加入CH3COONa晶体或加水稀释时,均会引起( )
A.溶液的pH都增加 B.CH3COOH电离程度增大
C.溶液导电能力都减弱 D.溶液中c(OH-) 都减小
难度: 简单查看答案及解析
-
在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )
A.NH4++2H2O
NH3·H2O+H3O+
B.HCO3-+ H2O
H3O+ + CO32-
C.HS-+H+=== H2S
D.Cl2+H2O
H++Cl-+HClO
难度: 简单查看答案及解析
-
如图所示:a、b、c、d均为铂电极,供选择的四组电解质溶液列表中,电解时要求满足的条件是:①通电一段时间后,甲、乙两池的pH均下降,②电极a、c上得到电子形成的原子个数比为1∶2,则电解液的编号正确的是 ( )
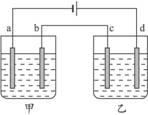
甲
乙
A
NaCl
AgNO3
B
AgNO3
CuCl2
C
CuSO4
AgNO3
D
H2SO4
AgNO3
难度: 简单查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序正确的是 ( )
A.10 mL 0.1 mol·L-1氨水与10 mL 0.1 mol·L-1盐酸混合,
c(Cl-)>c(
)>c(OH-)>c(H+)
B.10 mL 0.1 mol·L-1NH4Cl溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol·L-1CH3COOH溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol·L-1NaOH溶液与6 mL 1 mol·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
难度: 简单查看答案及解析
