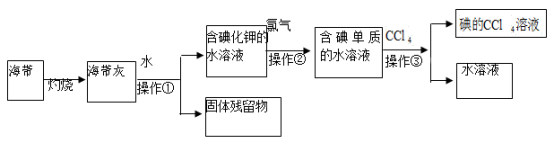
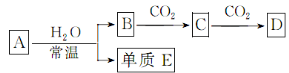
-
下列说法中不正确的是
A.分散质微粒直径介于
~
之间的分散系称为胶体
B.在水溶液或熔融状态下能够导电的化合物中一定存在离子键
C.液态氯化氢、熔融氧化铝、固体硫酸钡都是电解质
D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应
难度: 简单查看答案及解析
-
分类法在化学研究中起到了非常重要的作用。下列对物质的分类正确的组合是
①酸性氧化物:CO2、SO2、SiO2
②混合物:漂白粉、氨水、铝热剂
③电解质:氯气、硫酸钡、酒精
④同位素:12C、14C与14N
⑤同素异形体:C60、金刚石、石墨
⑥胶体:豆浆、硅酸、食盐水
A.只有①②④ B.只有②③④ C.只有①②⑤ D.只有②⑤⑥
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列有关说法不正确的是
A.标准状况下,22.4LN2与CO混合气体的质量为28g
B.常温常压下,金属与酸反应生成2g H2,转移电子数为2NA
C.含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子
D.1L1mol·L-1的氨水,含NA个NH3·H2O
难度: 中等查看答案及解析
-
菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是
A.在该反应中维生素C作催化剂
B.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷可能是+3价砷
C.因为河虾中含有砷元素,所以不能食用
D.上述反应中维生素C作氧化剂
难度: 中等查看答案及解析
-
下列有关化学实验叙述正确的是
A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水
B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶
C.在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中
D.若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH—==CaCO3↓+H2O
B.Fe(OH)3溶于氢碘酸: Fe(OH)3 + 3H+ ==Fe3+ + 3H2O
C.向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42ˉ离子沉淀完全Al3+ + 2SO42ˉ + 2Ba2+ + 4OHˉ ==Al(OH)4ˉ + 2BaSO4↓
D.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++ 2OH-+NH4++ HCO3-
NH3↑+2H2O+BaCO3↓
难度: 困难查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
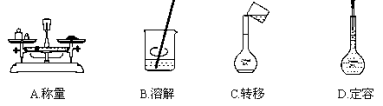
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.NH3通入AlC13溶液中
B.CO2通入到CaCl2溶液中
C.用脱脂棉包裹Na2O2粉末露置在潮湿空气中
D.稀盐酸滴加到Fe(OH)3胶体溶液中
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中可以大量共存的是
A.pH=12的溶液:Ca2+、NH4+、Br-、HSO3-
B.无色溶液:K+、A13+、HCO3—、C1—
C.通入H2 S无沉淀:Cu2+、Na+、I—、SO42—
D.c(H+)=1×10—2 mol/L的溶液:Fe3+、Ba2+、NO3-、Cl—
难度: 中等查看答案及解析
-
取xg铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mLN2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于
A.9.20g B.8.64g C.9.00g D.9.44g
难度: 中等查看答案及解析
-
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
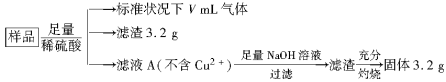
下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
难度: 困难查看答案及解析
-
下列各项操作中不发生先沉淀后溶解现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2
④向石灰水中通入过量CO2
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量
A. ① B. ②④⑤ C. ①②③⑤ D. ①③
难度: 简单查看答案及解析
-
a mol FeS与b mol FeO投入到V L c mol·L-1的硝酸溶液中,恰好完全反应,还原产物只有NO,所得澄清溶液可看作是Fe(NO3)3与H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ;②(a+b)×189g;③(a+b)mol ;④(V•c—
)mol
A.①④ B.②③ C.①③ D.②④
难度: 困难查看答案及解析
-
下列实验基本操作错误的是
A、滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
B、玻璃导管蘸水后,边旋转边向橡皮管中插入
C、加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
D、玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上
难度: 中等查看答案及解析
-
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2KI = I2+2KCl ②2FeCl3+2HI = I2+2FeCl2+2HCl ③2FeCl2+Cl2 = 2FeCl3 ④I2+SO2 +2H2O = 2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
难度: 中等查看答案及解析
-
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是
A.a点的溶液呈中性
B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— == Al(OH)3↓+2BaSO4↓
C.c点加入Ba(OH)2溶液的体积为200 mL
D.c点溶液呈碱性
难度: 困难查看答案及解析