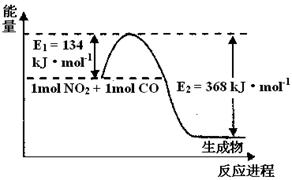
-
某化学反应其△H="=" —122 kJ/mol,?S="=" 231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
难度: 简单查看答案及解析
-
下列溶液分别加热蒸干,可以得到原溶质的是
A.Fe(NO3)2 B.AlCl3 C.Ca(HCO3)2 D.Na2CO3
难度: 简单查看答案及解析
-
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸.二元酸.多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③电解质:明矾.冰醋酸.纯碱;干冰.液氯都是非电解质
④同位素:1H.2H.3H;同素异形体:C60.金刚石.石墨
⑤根据分散系的稳定性大小将混合物分为胶体.溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
难度: 简单查看答案及解析
-
设NA为阿佛加德罗常数,下列说法中正确的是
A.0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA
B.0.1mol铁和O2在一定条件下生成FeO和Fe2O3混合物时,失去电子数为0.2NA
C.标况下,1L乙醇完全燃烧时产生CO2的分子数为NA/11.2
D.通常状态下,16克O2含氧原子数为0.5NA
难度: 简单查看答案及解析
-
一定能在下列溶液中大量共存的离子组是
A.水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+.Na+.Cl-.HCO3-
B.含有大量Fe3+的溶液:SCN-.I-.K+.Br-
C.能使pH试纸变蓝色的溶液:Na+.AlO2-.S2-.CO32-
D.澄清透明的无色溶液:ClO-.MnO4-.Al3+.SO42-
难度: 简单查看答案及解析
-
下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为-285.5kJ/mo1,则水电解的热化学方程式为:
2H2O(1) =2H2(g)+O2(g);△H=+285.5KJ/mo1
B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,它的热化学方程式为
1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(1);△H= 一445kJ/mol
C.已知2C(s)+O2(g)=2CO(g);△H= 一221kJ·mol-1,则C的燃烧热为一110.5kJ/mo1
D.HF与NaOH溶液反应:H+(aq)+OH—(aq)=H2O(1);△H= 一57.3kJ/mol
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
电解________
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.用惰性电极电解饱和食盐水:2Cl一 + 2H2O 2 OH一 + H2↑+ Cl2↑
C.过氧化钠投入重水中: Na2O2 + 2H2O = 2Na+ + O2↑+ 2OH一
D.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH一+2HCO3一=BaCO3↓+2H2O
难度: 简单查看答案及解析
-
已知某强氧化剂[RO(OH)2]2+离子2.4×10-3mol被亚硫酸钠还原到较低价态,需12mL0.2mol/L的亚硫酸钠溶液,则反应后R的化合价为
A.0 B.+2 C.+3 D.+4
难度: 困难查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液.(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
难度: 简单查看答案及解析
-
在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:
3A(g)+ B(g)=nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
在一个密闭容器中有CO.H2.O2共16.5g,用电火花点燃使其完全燃烧,再将燃烧后的气体用足量的Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是
A.36% B.54.5% C.40% D.33.3%
难度: 中等查看答案及解析
-
100℃时,Kw=10-12,将100℃时pH=10的NaOH溶液和pH=1的H2SO4混合,所得混合溶液的pH=2,则NaOH溶液和H2SO4溶液的体积比是
A.11 : 1 B.12 : 11 C.9 : 2 D.9: 1
难度: 中等查看答案及解析
-
下列图像能正确地表达可逆反应3A(g) + B(g)
2C(g)(△H<0)的是

难度: 困难查看答案及解析
-
将一定质量的镁.铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为16.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.标况下产物NO的体积为22.4升
难度: 困难查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体
④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
难度: 中等查看答案及解析
-
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的

A.含有大量SO42-的溶液中肯定存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
难度: 困难查看答案及解析