-
化学与生活密切相关。下列应用中利用了物质氧化性的是
A.明矾净水 B.纯碱去油污 C.食醋除水垢 D.漂白粉漂白织物
难度: 中等查看答案及解析
-
下列离子中半径最大的是
A.Na+ B.Mg2+ C.O2- D.F-
难度: 中等查看答案及解析
-
查阅元素周期表,从每个方格中不能得到的信息是
A.相对原子质量 B.元素名称 C.原子序数 D.同位素种类
难度: 中等查看答案及解析
-
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
难度: 中等查看答案及解析
-
某复合材料以碳纤维为增强体、金属钛为基体复合而成的。估计这种材料
①耐高温 ②不耐热 ③导电、导热 ④不导电、不导热
⑤可用于飞机机翼 ⑥可用于导弹的壳体
A.①③⑤⑥ B.②③⑤⑥ C.②③④ D.③④⑤
难度: 中等查看答案及解析
-
中国科学技术名词审定委员会确定第116号元素Lv的名称为鉝。关于
的叙述错误的是
A.原子序数116 B.中子数177
C.核外电子数116 D.相对原子质量293
难度: 简单查看答案及解析
-
有X、Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰为X原子的L层电子数的2倍,则X、Y元素的元素符号分别为
A.Mg和S B.N和Be C.Si和B D.C和Al
难度: 中等查看答案及解析
-
下列关于化学键的说法中,不正确的是
A.化学键是一种作用力
B.化学键可以使离子相结合,也可以使原子相结合
C.化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成
D.非极性键不是化学键
难度: 中等查看答案及解析
-
下列粒子中,与NH4+具有相同质子数和电子数的是
A.OH— B.F- C.Na+ D.NH3
难度: 中等查看答案及解析
-
不能作为判断硫、氯两种元素非金属性强弱的依据是
A.单质氧化性的强弱 B.氢化物沸点的高低
C.氢化物还原性强弱 D.最高价氧化物对应的水化物酸性的强弱
难度: 中等查看答案及解析
-
下列物质见光不会分解的是
A.HclO B.NH4Cl C.HNO3 D.AgNO3
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律分析下面的判断,其中错误的是
A.铍(Be)的原子失电子能力比镁弱 B.砹(At)的氢化物不稳定
C.硒(Se)化氢比硫化氢稳定 D.氢氧化锶[Sr(OH)2]比氢氧化钙碱性强
难度: 中等查看答案及解析
-
进行化学实验时应强化安全意识。下列做法正确的是
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C .浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
难度: 中等查看答案及解析
-
下列有关实验的现象描述正确的是
A.氢气在氯气中燃烧,火焰呈苍白色,瓶口出现大量白雾
B.磷在氯气中燃烧,发出明亮的蓝紫色火焰,产生大
量白色烟雾
C.铜在氯气中燃烧,产生白烟,加水溶解后可得蓝绿色溶液
D.用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
难度: 中等查看答案及解析
-
下列说法正确的是
A.同一主族相邻两个周期的元素的原子序数差一定等于上一周期所含元素种类
B.114号元素可能为非金属元素
C.L层上的电子数为奇数的元素一定是主族元素
D.目前使用的长式元素周期表中,最长的周期含36种元素
难度: 中等查看答案及解析
-
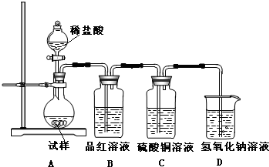
下列方法中,不能用于实验室制取氨的是
A.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B.加热试管中的氯化铵固体
C.将烧瓶中的浓氨水加热
D.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3
难度: 中等查看答案及解析
-
某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是
A.氧元素的相对原子质量为
B.1mol该原子质量为aNAg
C.xg该氧原子所含的电子的个数为
D.yg该氧原子的中子数一定为
难度: 中等查看答案及解析
-
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是

A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,
它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O
B.向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4NH3·H2O=[Al(OH)4]—+4NH4+
D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
难度: 中等查看答案及解析
-
某晶体中含有极性键,关于该晶体的说法错误的是
A.不可能有很高的熔沸点 B.不可能是单质
C.可能是有机物 D.可能是离子晶体
难度: 简单查看答案及解析
-
下列物质性质的变化规律,与共价键键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅
④NaF、NaCl、NaBr、NaI的熔点依次降低
A.仅③ B.①③ C.②③ D.②③④
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液中CO32-的水【解析】
CO32-+H2O=HCO3-+OH-C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
下列溶液,加热后颜色一定变浅的是
A.稀氨水和酚酞溶液 B.滴有酚酞的Na2CO3溶液
C.滴有酚酞的氢氧化钙溶液 D.溶有SO2的品红溶液
难度: 中等查看答案及解析
-
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2—与D+的核外电子数相等。则下列说法正确的是
A.B与A只能组成BA3化合物
B.第三周期中,D原子的原子半径最大
C.A、B、C三元素不可能形成离子化合物
D.E的氧化物对应水化物一定有强的氧化性
难度: 中等查看答案及解析
-
已知:①向饱和NaCl的氨气溶液中持续通入CO2气体;②向饱和Na2CO3溶液中通入足量的CO2气体。最终两种溶液中均会析出NaHCO3晶体,下列有关说法中错误的是
A.①中的离子反应方程式是:Na++NH3+CO2+H2O =NaHCO3↓ + NH4+
B
.②中的离子反应方程式是:2Na++CO32-+H2O+CO2 = 2NaHCO3↓
C.上述变化说明相同温度下溶解度Na2CO3 > NaHCO3 > NaCl
D.向饱和CaCl2溶液中加入浓Ba(OH)2溶液,也会析出晶体
难度: 中等查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是
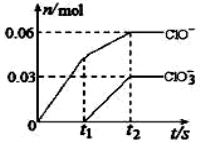
A.苛性钾溶液中KOH的物质的量是0.09mol
B.ClO3-的生成是由于氯气的量的多少引起的
C.在酸性条件下ClO-和ClO3-可生成Cl2
D.反应中转移电子的物质的量是0.21mol
难度: 困难查看答案及解析
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:
①3SiO2+6C+2N2
Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3
Si3N4+12HCl。则
下列叙述正确的是
A.反应②属于离子反应
B.若制取等量的Si3N4,则反应①②转移电子数目必然相等
C.反应①的氧化剂是N2
D.反应①中氧化产物与还原产物物质的量之比为1:6
难度: 中等查看答案及解析
-
下列反应中的氨与反应4NH3 + 5O2 → 4NO + 6H2O中的氨作用相同的是
A.2Na + 2NH3 → 2NaNH2 + H2↑ B.NH3 + HNO3→ NH4NO3
C.4NH3 + 6NO → 5N2 + 6H2O D.3SiH4 + 4NH3 → Si3N4 + 12H2
难度: 中等查看答案及解析
-
一般情况下,前者无法决定后者的是
A.原子核外电子排布——元素在周期表中的位置
B.弱电解质的相对强弱——电离常数的大小
C.分子间作用力的大小——分子稳定性的高低
D.物质内部储存的能量高低——化学反应的热效应
难度: 简单查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.二氧化硫体现还原性,做还原剂
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mol电子
D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2
难度: 中等查看答案及解析
-
某同学做了如下两个实验:
①将少量氯气通入FeI2与淀粉的混合溶液中,溶液变蓝色;
②将少量氯气通入到FeBr2与KSCN的混合溶液中溶液变红色。
由上述实验可以得出的结论是
A.氧化性:Cl2>Fe3+>Br2>I2
B.②发生反应Fe2++Cl2=Fe3++2Cl-
C.实验中只有氯气发生氧化反应
D.实验②发生的反应中,有一个是非氧化还原反应
难度: 中等查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a—的电子层结构与氦相同,b和c的次外层有8个电子,c—和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 中等查看答案及解析
-
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2。将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是
A.V=2.24L
B.参加反应的HCl为0.18mol
C.无法确定最终生成含钾化合物的数量是多少
D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2
难度: 困难查看答案及解析
-
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是

A.气体A是NO
B.X中不能确定的离子是 A13+和C1ˉ
C.溶液E和气体F能发生化学反应
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
难度: 困难查看答案及解析