-
2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是
A.X射线 B.天平 C.质谱 D.核磁共振
难度: 简单查看答案及解析
-
下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为强电解质
④C60、C70、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉、水雾、纳米材料均为胶体
A.①③④ B.②③ C.②④ D.②③④⑤
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A.CO2的电子式:
B.次氯酸的结构式: H—O—Cl
C.中子数为18的氯原子结构示意图:
D.二氧化硅的分子式为:SiO2
难度: 中等查看答案及解析
-
下列推断正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.Al2O3、MgO可用作高温材料,二氧化硅是生产光纤制品的基本原料
C.SO2气体通入紫色石蕊试液中,溶液先变红后褪色
D.新制氯水显酸性,可用pH试纸测定其酸碱度
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的
A.5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA
B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA
C.50 mL 12 mol•L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA
D.常温常压下,46g NO2 与 N2O4的混合气体中含有的原子总数为3NA
难度: 中等查看答案及解析
-
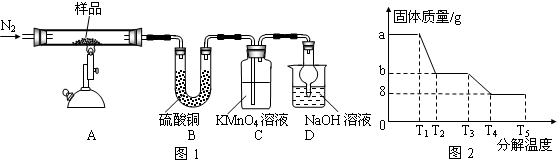
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+
难度: 中等查看答案及解析
-
某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-)︰n(SO42-)︰n(Fe3+)︰n(H+)︰n(X)=2︰3︰1︰3︰1,则X可能为
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
难度: 中等查看答案及解析
-
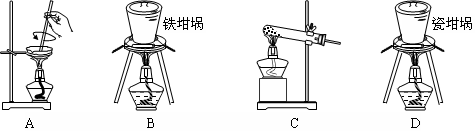
下列实验装置设计正确、且能达到目的的是
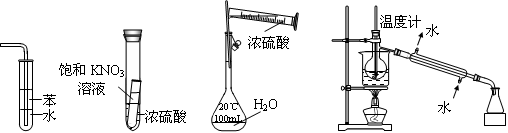
Ⅰ Ⅱ Ⅲ Ⅳ
A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
难度: 中等查看答案及解析
-
2013年6月20日,中国首次太空授课活动成功举行,神舟十号航天员王亚平在天宫一号展示了失重环境下的物理现象。若在天宫一号中进行以下实验,其中最难完成的是
A.将金粉和铜粉混合 B.将牛奶加入水中混合
C.蒸发食盐水制取食盐晶体 D.用漏斗、滤纸过滤除去水中的泥沙
难度: 中等查看答案及解析
-
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
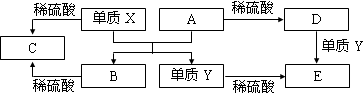
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
难度: 困难查看答案及解析
-
下列离子反应方程式正确的是
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42―
Cu2++ SO2↑+ 2H2O
B.电解饱和食盐水:2Cl- +2H+
H2↑+C12↑
C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O
难度: 中等查看答案及解析
-
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
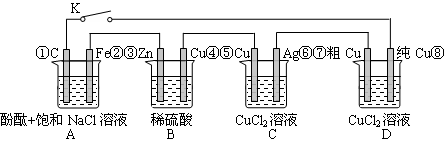
A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),

下列有关说法正确的是
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH
溶液→BaCl2溶液→过滤后加盐酸
B.工业上金属钠是通过氯碱工业制取
C.从第③步到第⑤步的目的是为了浓缩
D.在第③④⑤步中溴元素均被氧化
难度: 中等查看答案及解析
-
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
A.原子半径:Z>R>W
B.X2W6分子中各原子均满足8电子结构
C.气态氢化物的稳定性:HmW>HnR
D.Y、Z形成的化合物中只可能存在离子键
难度: 中等查看答案及解析
-
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
A.n(烧碱)<n(稀硝酸)<n(盐酸) B.n(烧碱)<n(盐酸)<n(稀硝酸)
C.n(稀硝酸)<n(烧碱)<n(盐酸) D.n(盐酸)<n(稀硝酸)<n(烧碱)
难度: 中等查看答案及解析
-
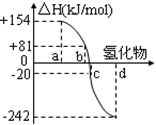
下列有关说法正确的是
A.在潮湿的空气中,马口铁和白铁皮镀层受损后,铁都比受损前更容易生锈
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的ΔH<0
C.反应N2(g)+3H2(g)
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):
H2(g) +Cl2(g)=2HCl(g) △H1=-Q1 kJ·mol-1
H2(g) +Br2(g)=2HBr(g) △H2=-Q2 kJ·mol-1 则△H1<△H2
难度: 中等查看答案及解析
-
一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g) + Y(g)
2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
A.用X表示5min内此反应的反应速率是(0.1—0.2a)mol·(L·min)—1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入l mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序列
参加反应的物质
生成物
①
KMnO4 、H2O2 、H2SO4
K2SO4 、MnSO4 ……
②
Cl2 、FeBr2
FeCl3 、FeBr3
③
MnO4- ……
Cl2 、Mn2+ ……
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
难度: 中等查看答案及解析
-
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.合金的熔点一般比组分金属低
B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
难度: 中等查看答案及解析
-
某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol·L-1的硫酸溶液恰好完全吸收,酸也不剩余。
根据上述实验,以下推测不正确的是
A.原溶液一定不存在较大浓度的H+、Mg2+
B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1
C.不能确定原溶液是否含有K+、NO3-
D.实验中产生的棕色气体遇空气颜色会加深
难度: 困难查看答案及解析