-
下列基态原子的核外电子排布违背洪特规则的是
A.C:1s22s12p3 B.N:1s22s32p2 C.O:1s22s22px22py2 D.Cu:[Ar]3d94s2
难度: 简单查看答案及解析
-
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
难度: 简单查看答案及解析
-
在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
A.Li,F B.Na,F C.Na,C1 D.Mg,O
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系正确的是
A.υ(W)=3υ(Z) B.2υ(X)=3υ(Z) C.2υ(X)=v(Y) D.3υ(W)=2υ(X)
难度: 简单查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 简单查看答案及解析
-
根据下图,可判断出下列离子方程式中错误的是
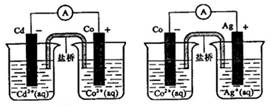
A.2Ag(s)+Cd2+(aq)==2Ag+( aq) +Cd(s) B.Cd(s)+Co2+(aq)==Cd2+( aq) +Co(s)
C.2Ag+(aq)+Cd(s)==2Ag(s ) +Cd2+(aq) D.2Ag+(aq)+Co(s)==2Ag(s ) +Co2+(aq)
难度: 简单查看答案及解析
-
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> Ag2CrO4 B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
难度: 简单查看答案及解析
-
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(H+)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3-)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
难度: 简单查看答案及解析
-
一些烷烃的燃烧热如下表:下列表达正确的是
烷烃
燃烧热/kJ·mol-1
烷烃
燃烧热/kJ·mol-1
甲烷
891.0
正丁烷
2878.0
乙烷
1560.8
异丁烷
2869.6
丙烷
2221.5
异戊烷
3531.3
A.正戊烷的燃烧热小于3531.3 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)==4CO2(g)+6H2O(g) △H=-1560.8 kJ·mol-1
D. 相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多
难度: 简单查看答案及解析
-
已知:H2O(g)==H2O(l) △H1=-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)==C2H5OH(l) △H2=-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)
A. Q1+Q2+Q3 B. 0.5(Q1+Q2+Q3) C. 0.5Q1-1.5Q2+0.5Q3 D. 1.5Q1-0.5Q2+0.5Q3
难度: 简单查看答案及解析
-
下列关于微粒结构的描述正确的是
A.CS2为V形的极性分子
B.ClO3—的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO 32—的中心原子均为sp3杂化
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.第一电离能由大到小的顺序是Z>W>X>Y
难度: 简单查看答案及解析
-
对于常温下pH为1的硝酸溶液,下列叙述正确的是
A.该溶液lmL稀释至100mL后,pH等于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出c(H+)的之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
难度: 简单查看答案及解析
-
现有a mol/L NaX和bmol/L NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY
B.若a>b且c(X-)=c(Y-),则酸性HX<HY
C.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则a=b=0.1mol/L
难度: 简单查看答案及解析
-
下列说法正确的是
A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0,△S>0
B.水解反应NH4++H2O
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
难度: 简单查看答案及解析
-
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段。下列叙述不正确的是
A.阴极自始至终只析出氢气 B.阳极先析出Cl2,后析出O2
C.电解的最后阶段为电解水 D.溶液pH不断增大,最后pH=7
难度: 简单查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,t表示温度,n表示物质的量):
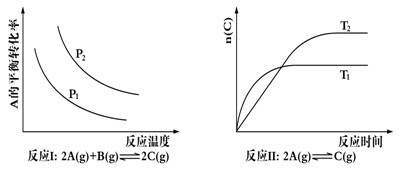
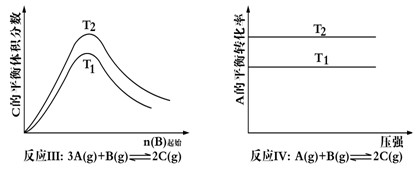
根据以上规律判断,下列结论正确的是
A.反应Ⅰ△H> 0,P2>P1 B.反应Ⅱ△H<0,T1>T2
C.反应Ⅲ△H> 0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ△H<0,T2>T1
难度: 简单查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)
2NH3(g) ⊿H=-92.4kJ·mol-1]
容器
甲
乙
丙
反应物投入量
1molN2、3molH2
2molNH3
4molNH3
NH3的浓度(mol·L-1)
c1
c2
c3
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
下列说法正确的是
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3<1
难度: 简单查看答案及解析