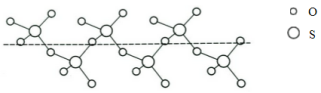
-
化学与人类生活、能源开发、资源利用等密切相关。下列说法正确的是 ( )
A.家中做卫生保洁时,可将漂白粉与洁厕精(含浓盐酸)混合使用
B.Na2O2可作漂白剂和供氧剂,碳酸钠可用于
治疗胃酸过多
C.可以用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2(g)
D.施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
难度: 简单查看答案及解析
-
分析生产生活中的下列过程,不涉及氧化还原反应的是( )
A.煤液化制得清洁能源 B
.人工固氮
C.将氯气通入冷的消石灰中制漂白粉 D.从海水中提取氯化镁
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.6 g SiO2晶体中含有的硅氧共价键数目为0.2NA
B.标准状况下,2.24 LSO3含有的分子数目为0.1NA
C.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
D.高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是( )
A.A1Cl3 B.Na2O
C.FeCl2 D.SiO2
难度: 简单查看答案及解析
-
新型陶瓷AlN可通过反应: Al2O3+N2+3C
2AlN+3CO合成。下列正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.AlN中氮元素的化合价为+3
C.上述反应中,每生成1 mol AlN需转移3 mol电子
D.AlN的摩尔质量为41 g
难度: 简单查看答案及解析
-
已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4
下列结论正确的是 ( )
A.①②③均是氧化还原反应
B.反应②中氧化剂与还原剂的物质的量之比为1∶6
C.氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3
D.反应③中0.1mol还原剂共失去电子数为0.5NA
难度: 困难查看答案及解析
-
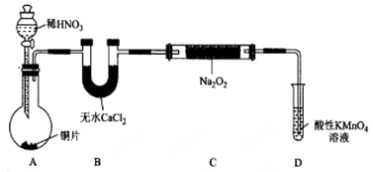
如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各组物质能利用这套装置进行实验的是 ( )
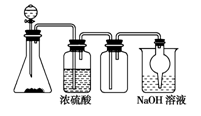
A.MnO2和浓盐酸
B. 浓氨水和生石灰
C.Cu片和稀HNO3
D.Na2SO3(s)和浓H2SO4
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.氢氧化亚铁溶于稀硝酸:Fe(OH)
2+2H+=Fe2++2H2O
B.NH4Al(SO4)2溶液与
过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O
C.Na2SiO3溶液与稀盐酸混合:Na2SiO3+2H+=2Na++H2SiO3↓
D.Ca(HCO3)2溶液和Ca(OH)2溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列A—D四组,每组有两个反应,其中两个反应能用同一离子方
程式表示的是( )
(Ⅰ)
(Ⅱ)
A
少量H2SO4滴入Ba(OH)2溶液中
少量NaHSO4滴入Ba(OH)2溶液中
B
少量NaOH滴入Al2(SO4)3溶液中
少量Al2(SO4)3溶液滴入氨水中
C
少量SO2通入Ba(NO3)2溶液中生成白色沉淀
少量SO2通入Ba(OH)2溶液中生成白色沉淀
D
0.1 mol Cl2通入含0.2 mol FeBr2的溶液中
0.1 mol Cl2通入含0.2 mol FeCl2的溶液中
难度: 困难查看答案及解析
-
下列实验方案,不能达到实验目的的是( )
选项
实验目的
实验方案
A
检验食盐中是否添加KIO3
取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝
B
验证氯酸钾中含有氯元素
取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入稀硝酸酸化的AgNO3溶液,观察是否有白色沉淀
C
验证硝酸是挥发性酸
用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生
D
验证Br2氧化性强于Fe3+
取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红
难度: 中等查看答案及解析
-
海藻中含丰富的、以离子形式存在的碘元素。下图是
实验室从海藻里提取碘的流程的一部分:
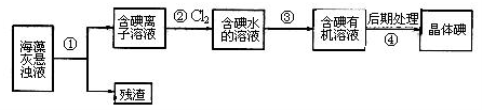
下列判断正确的是( )
A.步骤①、③的操作分别是过滤、萃取分液
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加人的有机溶剂是乙醇
D.步骡④的操作是过滤
难度: 中等查看答案及解析
-
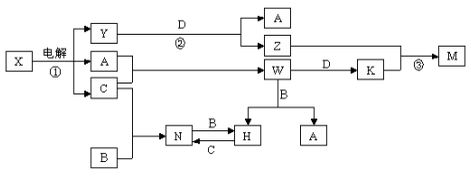
工业上用铝土矿(主要成分为Al2O3
,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下图所示:
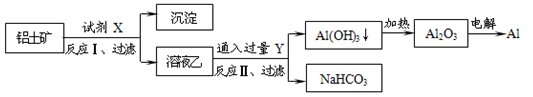
对上述流程中的判断正确的是( )
①试剂X为稀硫酸,沉淀中含有硅的化合物
②反应 II 中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
③结合质子(H+) 的能力由弱到强的顺序是OH->AlO2->CO32-
④Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
A. ①② B.②③ C.①④ D.③④
难度: 困难查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
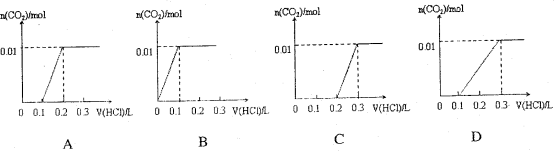
难度: 困难查看答案及解析
-
1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A.504 mL B.168 mL C.224mL D.336 mL
难度: 困难查看答案及解析